
| A. | 该反应会放出热量 | |
| B. | 每生成1mol N2,转化电子数为4mol | |
| C. | 等物质的量N2和CO质量相同 | |
| D. | 该反应不需要催化剂常温下也能发生 |
分析 反应2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2中,需在催化条件下进行,N元素化合价由+2价降低到0价,C元素化合价由+2价升高到+4价,为放热反应,以此解答该题.
解答 解:A.反应为放热反应,会放出热量,故A正确;
B.反应中N元素化合价由+2价降低到0价,C元素化合价由+2价升高到+4价,则每生成1mol N2,转化电子数为4mol,故B正确;
C.N2和CO的相对分子质量都为28,则等物质的量N2和CO质量相同,故C正确;
D.反应需在催化剂条件下进行,故D错误.
故选D.
点评 本题考查较为综合,涉及化学反应与能量变化、氧化还原反应计算等,为高频考点,侧重考查学生的双基,有利于培养学生良好的科学素养,提高学习的积极性,难度中等,注意理解氧化还原反应中电子转移守恒.


科目:高中化学 来源: 题型:选择题
| A. | 75% | B. | 50% | C. | 25% | D. | 20% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该条件下Z是气态 | B. | 平衡常数K=$\frac{c(Z)•c(W)}{c(X)•c(Y)}$ | ||
| C. | 增加Z平衡逆向移动 | D. | 上述过程中X的转化率变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 很多城市对废旧电池进行回收处理 | |
| B. | 有些国家对聚乙烯等塑料垃圾进行了深埋或者倾倒入大海处理 | |
| C. | 不少地区正在使用沼气,太阳能,风能等能源替代传统的煤炭 | |
| D. | 许多地方政府出台相关法规来保护生物物种多样性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 可能影响因素 | 实验操作 | 预期现象和结论 |
| ①溶液的酸性 | 取少量0.5mol•L-1Fe(NO3)3于试管中,加入几滴3.0mol•L-1HNO3. | 现象:棕黄色溶液颜色变浅; 结论:酸性增强抑制Fe3+水解. |
| ②溶液的浓度 | 取10mL0.5mol•L-1 Fe(NO3)3于烧杯中,用pH计测得pH1.另取90mL蒸馏水加入烧杯,充分搅拌,再测得pH2. | 现象:pH2-pH1<1(或正确表达) 结论:稀释促进水解(或平衡右移) |
| ③溶液的温度 | 取少量0.5mol•L-1Fe(NO3)3于试管中,用酒精灯加热一段时间,观察溶液颜色 | 现象:加热后溶液颜色变深 结论:升高温度促进Fe3+水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
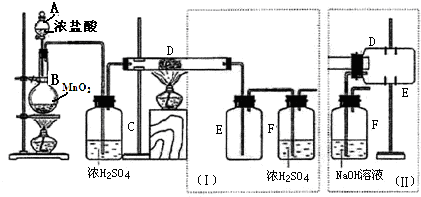
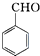 +KOH→
+KOH→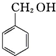 +
+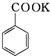
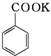 +HCl→
+HCl→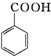 +KCl
+KCl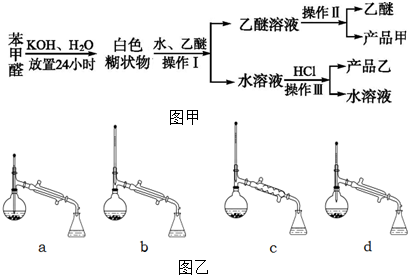
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知:P4(白磷,s)═4P(红磷,s)△H<0,则白磷比红磷稳定 | |
| B. | 由CH3CH2CH2CH3(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(g)△H=-2658 kJ•mol-1可知正丁烷的标准燃烧热为2658 kJ•mol-1 | |
| C. | OH-(aq)+H+(aq)═H2O(l)△H=-57.3 kJ•mol-1,故1 mol醋酸与1 mol NaOH完全反应,放出的热量为57.3 kJ•mol-1 | |
| D. | 已知:2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1 N2(g)+O2(g)═2NO(g)△H=+180 kJ•mol-1 则2CO(g)+2NO(g)═N2(g)+2CO2(g)△H=-746 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
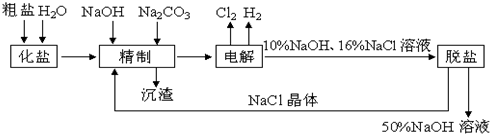
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去铁粉中混有少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤 | |
| B. | 光照氯水有气泡冒出,该气体主要为Cl2 | |
| C. | 制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中 | |
| D. | Na[Al(OH)4]溶液和盐酸可以通过相互滴加的方法来鉴别,NaHCO3溶液和Ca(OH)2溶液也可以通过相互滴加的方法来鉴别 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com