
| A. | 氯化氢分子的电子式: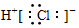 | B. | 乙烯的最简式:CH2 | ||
| C. | 苯的分子式:C6H6 | D. | 氯的原子结构示意图: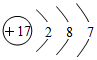 |
分析 A.氯化氢为共价化合物,分子中不存在阴阳离子;
B.最简式是用元素符号表示化合物分子中各元素的原子个数比的最简关系式;
C.根据苯是由6个碳原子和6个氢原子组成的平面型分子;
D.氯原子含有17个质子和17个电子.
解答 解:A.氯化氢分子中不存在氢离子和氯离子,氯化氢的电子式为: ,故A错误;
,故A错误;
B.乙烯的分子式为:CH2=CH2,最简式为:CH2,故B正确;
C.苯是由6个碳原子和6个氢原子组成的平面型分子,分子式为C6H6,故C正确;
D.氯原子含有17个质子和17个电子,原子核外有3个电子层,最外层有7个电子,原子结构示意图为: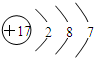 ,故D正确;
,故D正确;
故选A.
点评 本题主要考查常用化学用语的书写,难度不大,掌握常用化学用语的书写,注意共价化合物和离子化合物电子式书写的区别.


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:解答题
 金属及其化合物在化学中扮演着重要的角色,试根据各物质的性质完成下列问题:(1)钠与水反应时,钠漂浮在水面上.甲同学用刺有小孔的铝箱将0.46g钠包裹,而后投入水中,使钠沉入水底与水(足量)反应.反应结束后,生成的气体体积大于(填“大于”“小于”或“等于”) 224mL (标准状况).
金属及其化合物在化学中扮演着重要的角色,试根据各物质的性质完成下列问题:(1)钠与水反应时,钠漂浮在水面上.甲同学用刺有小孔的铝箱将0.46g钠包裹,而后投入水中,使钠沉入水底与水(足量)反应.反应结束后,生成的气体体积大于(填“大于”“小于”或“等于”) 224mL (标准状况). CuSO4+SO2↑+2H2O,生成SO2的物质的量小于0.46mol的原因是随着反应的进行硫酸的浓度逐渐减小,铜不与稀硫酸反应,所以产生SO2的物质的量小于0.46mol.
CuSO4+SO2↑+2H2O,生成SO2的物质的量小于0.46mol的原因是随着反应的进行硫酸的浓度逐渐减小,铜不与稀硫酸反应,所以产生SO2的物质的量小于0.46mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
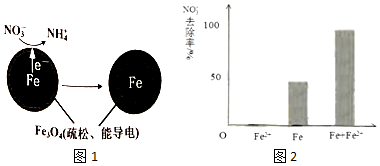
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH=CH2和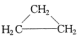 | B. | 乙炔和苯 | C. |  和 和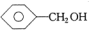 | D. | 乙酸和甲酸甲酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH中氢是+1价 | |
| B. | NaH中阴离子半径比锂离子半径小 | |
| C. | NaH中阴离子的电子层排布与氦原子相同 | |
| D. | NaH中阴离子可被还原成氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
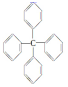 对该分子的描述,不正确的是( )
对该分子的描述,不正确的是( )| A. | 化学式为C25H20 | B. | 所有碳原子都在同一平面上 | ||
| C. | 此分子中有极性键和非极性键 | D. | 此物质属芳香烃类物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
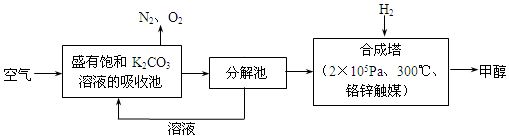

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
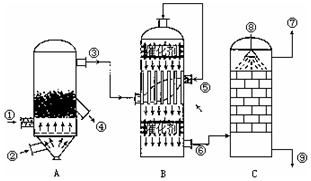
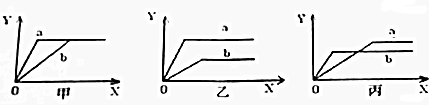
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com