
| A. | Fe和盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硫酸与氢氧化钡溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| C. | Cu和AgNO3溶液反应:Cu+Ag+═Cu2++Ag | |
| D. | 石灰石和盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
分析 A.不符合反应客观事实;
B.离子个数配比不符合物质结构;
C.电荷不守恒;
D.二者反应生成氯化钙和二氧化碳、水.
解答 解:A.Fe和盐酸反应生成氯化亚铁,离子方程式:Fe+2H+═Fe2++H2↑,故A错误;
B.硫酸与氢氧化钡溶液反应,离子方程式:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故B错误;
C.Cu和AgNO3溶液反应,离子方程式:Cu+2Ag+═Cu2++2Ag,故C错误;
D.石灰石和盐酸反应,离子方程式:CaCO3+2H+═Ca2++CO2↑+H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应遵循客观事实、遵循原子个数、电荷守恒规律.


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe3+、OH一、HCO3- | B. | Ba2+、OH一、C1- | C. | H+、K+、CO32-、 | D. | NH4+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag2O 被还原,是负极材料 | |
| B. | 正极增重16 克时电路中有2NA个电子转移 | |
| C. | 用该电池进行电解水试验,每生成标况下aLO2,电池负极增重16a/11.2 克 | |
| D. | 该电池的电解质溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
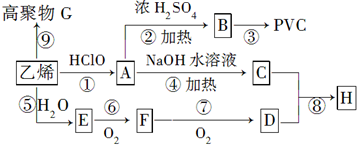
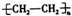 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
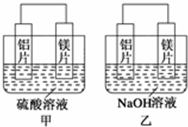 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol•L-1的H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol•L-1的H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com