
【题目】某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
![]()
CO的制备原理:HCOOH ![]() CO↑+H2O,并设计出原料气的制备装置(如下图)
CO↑+H2O,并设计出原料气的制备装置(如下图)

请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氢气、丙烯。写出制备丙烯的化学方程式: _____ 。
(2)若用以上装置制备干燥纯净的CO,装置中a的作用是 ____ ,装置中b的作用是________,c中盛装的试剂是 _____。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是______(填序号)
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:
①R-CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线:

试剂1为 ____ ,操作2为 ___ ,操作3为_____。
【答案】(CH3)2CHOH![]() CH2=CHCH3↑+H2O 保证分液漏斗内外压强平衡,便于液体顺利流下 作为安全瓶,防倒吸 NaOH溶液 ④⑤①⑤③②(答④⑤①③②也给分) 饱和NaHSO3溶液 萃取 蒸馏
CH2=CHCH3↑+H2O 保证分液漏斗内外压强平衡,便于液体顺利流下 作为安全瓶,防倒吸 NaOH溶液 ④⑤①⑤③②(答④⑤①③②也给分) 饱和NaHSO3溶液 萃取 蒸馏
【解析】
(1)制备丙烯选用2-丙醇和浓硫酸发生消去反应,反应的方程式为:(CH3)2CHOH![]() CH2=CHCH3↑+H2O 。答案:(CH3)2CHOH
CH2=CHCH3↑+H2O 。答案:(CH3)2CHOH![]() CH2=CHCH3↑+H2O。
CH2=CHCH3↑+H2O。
(2)在题给装置中,a的作用保持分液漏斗和烧瓶内的气压相等,以保证分液漏斗内的液体能顺利加入烧瓶中;b主要是起安全瓶的作用,以防止倒吸;c为除去CO中的酸性气体,选用NaOH溶液,d为除去CO中的H2O,试剂选用浓硫酸;答案:保证分液漏斗内外压强平衡,便于液体顺利流下、作为安全瓶、防倒吸、NaOH溶液。
(3)检验丙烯和少量SO2、CO2及水蒸气组成的混合气体各成分时,应首先选④无水CuSO4检验水蒸气,然后用⑤品红溶液检验SO2,并用①饱和Na2SO3溶液除去SO2,再用⑤品红溶液检验SO2是否除净;最后用③石灰水检验CO2、用②酸性KMnO4溶液检验丙烯。综上所述,混合气体通过试剂的顺序是④⑤①⑤③② 或(或④⑤①③②)
(4)粗品中含有正丁醛,根据所给的信息利用饱和NaHSO3 溶液形成沉淀,然后通过过滤即可除去;由于饱和NaHSO3 溶液是过量的,所以加入乙醚的目的是萃取溶液中的1-丁醇.因为1-丁醇和乙醚的沸点相差很大,因此可以利用蒸馏将其分离开。故答案为:饱和NaHSO3 溶液;萃取;蒸馏.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】现有CO和CO2的混合气体20克,其在标准状况下的体积为11.2L。据此回答下列问题:
(1)该混合气体总的物质的量为______,其平均摩尔质量为_______。
(2)混合气体中碳原子的个数为________。(用NA表示阿伏加德罗常数的值)
(3)若将该混合气体全部通过下图装置进行实验。

则:①气球中收集的气体是______,其质量为_______ 克
②从A瓶中获得沉淀质量的操作是_____、称量。
③若要证明A瓶溶液中的阳离子是否沉淀完全,其方法为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700~900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是

A. 电池总反应为:N2H4+2O2=2NO+2H2O
B. 电池内的O2-由电极乙移向电极甲
C. 当甲电极上有lmol N2H4消耗时,乙电极上有22.4LO2参与反应
D. 电池正极方程式为:O2 + 4e-+2H2O=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学观或化学研究方法的叙述中,错误的是( )
A. 在化工生产中应遵循“绿色化学”的思想
B. 在过渡元素中寻找优良的催化剂
C. 在元素周期表的金属和非金属分界线附近寻找半导体材料
D. 根据元素周期律,由HClO4可以类推出氟元素的最高价氧化物的水化物为HFO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表、元素周期律的说法正确的是
A.元素周期表有8个周期B.IA族元素均为金属元素
C.铝元素的主族序数与其周期数相等D.稀有气体元素原子的最外层电子数均为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业锅炉内壁的水垢,不仅浪费燃料,而且容易引发安全隐患。某碳素钢锅炉水垢(主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3、SiO2等)碱煮法清除的流程如下:

已知:20℃时几种难溶物的溶度积常数如下表(单位省略):

回答下列问题:
(1)“碱煮”环节,加入Na3PO4的主要目的是将CaSO4转化为Ca3(PO4)2,请写出该离子方程式______________________。
(2)“浸泡过程中,稀盐酸会溶解Fe2O3。溶解后的Fe2O3会加速锅炉腐蚀,故需“还原”处理。
①锅炉被加速腐蚀的原因是______________________;
②浸泡液还原”处理时,Sn2+转化为Sn4+,则反应中氧化剂与还原剂的物质的量之比为______________________。
(3)“钝化”处理的目的是在锅炉表面形成Fe3O4保护膜,同时生成可直接参与大气循环的气体。
①反应的离子方程式为_________________________________;
②为检验锅炉“钝化”处理后是否形成致密的保护膜,可往锅炉内壁刷上硫酸铜溶液。若观察到______________________(填现象),则保护膜致密性欠佳。
(4)柠檬酸(用H3R表示)可用作清除锅炉水垢的酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图所示。由此可推知,0.1 mol ·L-1 Na2HR溶液中各种阴离子浓度由大到小的排列顺序为______________________。
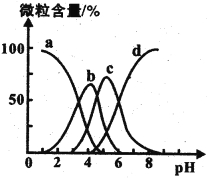
(5)用如图装置对锅炉用水(含Ca2+、Mg2+、HCO3-)进行预处理,可有效防止水垢形成。电解时,Ca2+形成沉淀的电极反应式为______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应 2NO2(g)![]() N2O4 (g)在体积不变的密闭容器中反应,达到平衡状态的标志是
N2O4 (g)在体积不变的密闭容器中反应,达到平衡状态的标志是
①单位时间内生成 n mol N2O4 的同时生成 2n mol NO2
②单位时间内消耗 n mol N2O4的同时生成 2n mol NO2
③用NO2、N2O4的物质的量浓度变化表示的反应速率的比为2:1 的状态
④混合气体的颜色不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
A. ①④⑤B. ②⑤C. ①③④D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰是一种重要的化工中间体,是锰行业研究的热点。一种以高硫锰矿(主要成分为含锰化合物及FeS)为原料制备硫酸锰的工艺流程如下:

已知:①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO。
②金属离子在水溶液中的平衡浓度与pH的关系如图所示(25℃):

③此实验条件下Mn2+开始沉淀的pH为7.54;离子浓度≤10-5mol·L-1时,离子沉淀完全。
请回答:
(1)传统工艺处理高硫锰矿时,不经“混合焙烧”,而是直接用H2SO4浸出,其缺点为___________。
(2)“氧化”时,发生反应的离子方程式为_________________________________。若省略“氧化”步骤,造成的后果是_________________________________。
(3)“中和除杂”时,生成沉淀的主要成分为______________________(填化学式)。
(4)“氟化除杂”时,若使溶液中的Mg2+和Ca2+沉淀完全,需维持c(F-)不低于___________。(已知:Ksp(MgF2)=6.4×10-10;Ksp(CaF2)=3.6×10-12)
(5)“碳化结晶”时,发生反应的离子方程式为______________________。
(6)“系列操作”指___________、过滤、洗涤、干燥
(7)用惰性电极电解MnSO4溶液可制备MnO2,电解过程中阳极的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示实验室某浓盐酸试剂瓶上的标签,试根据标签上的有关数据回答下列问题:

(1)该浓盐酸的物质的量浓度为______mol·L-1。
(2)取用任意体积的该浓盐酸时,下列物理量中不随所取体积的多少而变化的是______(填字母代号)。
A.溶液中HCl的物质的量 B.溶液的浓度 C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制480 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取__mL(保留一位小数)上述浓盐酸进行配制。如果实验室有5mL、10mL、50mL量筒,应选用____mL量筒最好。若量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将___(偏高、偏低、无影响)。
②配制时所需仪器除了量筒外,还需要的仪器有:_________。
③下列情况会导致所配溶液的浓度偏低的是__________(填字母代号)。
A.浓盐酸挥发,浓度不足 B.配制前容量瓶中有少量的水
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com