
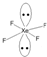
| A. | PCl5 | B. | BF3 | C. | CCl4 | D. | NH3 |
分析 对于ABn型共价化合物元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构,据此判断.
解答 解:A、PCl5中P元素化合价为+5,P原子最外层电子数为5,所以5+5=10,P原子不满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以1+7=8,Cl原子满足8电子结构,故A错误;
B、BF3中B元素化合价为+3,B原子最外层电子数为3,所以3+3=6,B原子不满足8电子结构;F元素化合价为-1,F原子最外层电子数为7,所以1+7=8,F原子满足8电子结构,故B错误;
C、CCl4中C元素化合价为+4,C原子最外层电子数为4,所以4+4=8,C原子满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以1+7=8,Cl原子满足8电子结构,故C正确;
D、NH3中N元素化合价为-3,N原子最外层电子数为5,所以3+5=8,O原子满足8电子结构;H元素化合价为+1,H原子最外层电子数为1,所以1+1=2,H原子不满足8电子结构,故D错误;
故选C.
点评 本题考查8电子结构的判断,难度不大,清楚元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构是关键,注意离子化合物不适合.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
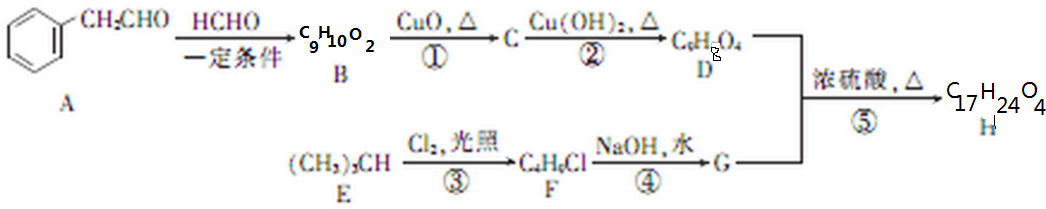
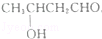
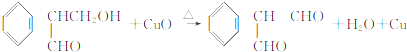
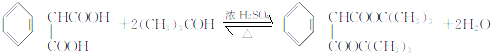
 (不考虑立体异构)?
(不考虑立体异构)?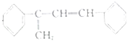 的合成路线.
的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
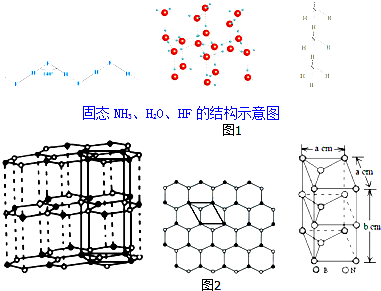
 .
.| 物质 | 氢键X-H…Y | 键能/kJ•mol-1 |
| (HF)n | F-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2+O2═2H2O△H=-571.6KJ/mol | |
| B. | H2 (g)+$\frac{1}{2}$O2(g)═H2O (l)△H=-142.9KJ/mol | |
| C. | H2 (g)+$\frac{1}{2}$O2(g)═H2O (l)△H=-285.8KJ/mol | |
| D. | 2H2(g)+O2(g)═2H2O (g)△H=-571.6KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com