
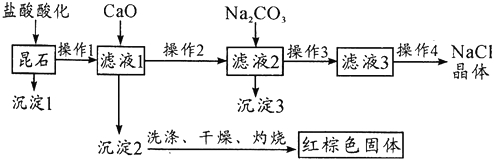
分析 昆石加入盐酸,生成钠盐、铁盐、钙盐,过滤除去二氧化硅,加入CaO调节pH,红棕色固体为Fe(OH)3,加入Na2CO3沉淀Ca2+,过滤得到NaCl溶液,蒸发结晶得到NaCl晶体;
(1)操作1之后出现沉淀和滤液,则操作1是过滤;操作4出现晶体,则操作4是蒸发结晶;
(2)加CaO时,CaO和H2O反应生成氢氧化钙,CaO调节pH生成Fe(OH)3沉淀,离子方程式为:CaO+H2O=Ca2++2OH-、CaO+2H+→Ca2++H2O、Fe3++3OH-→Fe(OH )3↓;
(3)FeCl3水解生成Fe(OH)3,沉淀中附着Cl-,可以检验Cl-来判断沉淀是否已经洗涤干净;
(4)钠元素不能生成沉淀,常用焰色反应检验钠元素;
(5)红棕色固体为Fe(OH)3,证明是否含有Fe3+,首先取红棕色固体少许,用盐酸溶解,滴入2滴KSCN溶液检验.
解答 解:(1)操作1之后出现沉淀和滤液,则操作1是过滤;操作4出现晶体,则操作4是蒸发结晶,故答案为:过滤;蒸发结晶;
(2)加CaO时,CaO和H2O反应生成氢氧化钙,CaO调节pH生成Fe(OH)3沉淀,离子方程式为CaO+H2O=Ca2++2OH-、CaO+2H+=Ca2++H2O、Fe3++3OH-=Fe(OH )3↓,
故答案为:CaO+H2O=Ca2++2OH-、CaO+2H+=Ca2++H2O、Fe3++3OH-=Fe(OH )3↓;
(3)FeCl3水解生成Fe(OH)3,沉淀中附着Cl-,可以检验Cl-来判断沉淀是否已经洗涤干净,其操作为取洗涤液少许于试管中滴入硝酸酸化的硝酸银溶液,若无沉淀证明已经洗涤干净;
故答案为:取洗涤液少许于试管中滴入硝酸酸化的硝酸银溶液,若无沉淀证明已经洗涤干净;
(4)钠元素不能生成沉淀,常用焰色反应检验钠元素,操作为用铂丝蘸取滤液3,放在酒精灯的外焰灼烧,火焰呈黄色,证明含有钠元素,
故答案为:用铂丝蘸取滤液3,放在酒精灯的外焰灼烧,火焰呈黄色,证明含有钠元素;
(5)红棕色固体为Fe(OH)3,证明是否含有Fe3+,首先取红棕色固体少许,用盐酸溶解,滴入2滴KSCN溶液,溶液变为红色,证明含有金属铁元素,
故答案为:取红棕色固体少许,用盐酸溶解,滴入2滴KSCN溶液,溶液变为红色,证明含有金属铁元素.
点评 本题考查二氧化硅以及铁、钠、钙元素的氧化物的性质,难度不大,涉及实验操作及元素的检验.


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| 编号 | 温度(℃) | 起始物质的量 (mol) | 平衡物质的量 (mol) | 达到平衡所需时间 (s) | |
| PCl5(g) | PCl3(g) | Cl2(g) | |||
| Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
| Ⅱ | 320 | 0.80 | t2 | ||
| Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
| A. | 平衡常数K:容器Ⅱ>容器Ⅲ | |
| B. | 反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ | |
| C. | 反应到达平衡时,容器I中的平均速率为v(PCl5)=$\frac{0.10}{{t}_{1}}$mol/(L•s) | |
| D. | 起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl30.45 mol和Cl20.10 mol,则反应将向逆反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中三个碳原子可能处在同一直线上 | |
| B. | 它的五氯代物数目与三氯代物的数目相等 | |
| C. | 它属于烃类 | |
| D. | 该物质易溶于水,难溶于有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度、体积不变,充入氩气 | B. | 条件不变,对体系加热 | ||
| C. | 温度、体积不变,充入氯气 | D. | 温度不变,增大容器体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2 | B. | CO | C. | C12H22O11 | D. | C6H12O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ④
④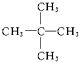 ⑤
⑤ ⑥CH3-CH═CH2 ⑦
⑥CH3-CH═CH2 ⑦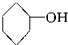 ⑧
⑧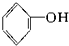 ⑨
⑨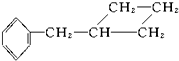 中,属于环状化合物的是③⑤⑦⑧⑨,属于脂环化合物的是⑤⑦,属于芳香化合物的是③⑧⑨,属于脂肪烃的是①②④⑥.
中,属于环状化合物的是③⑤⑦⑧⑨,属于脂环化合物的是⑤⑦,属于芳香化合物的是③⑧⑨,属于脂肪烃的是①②④⑥.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
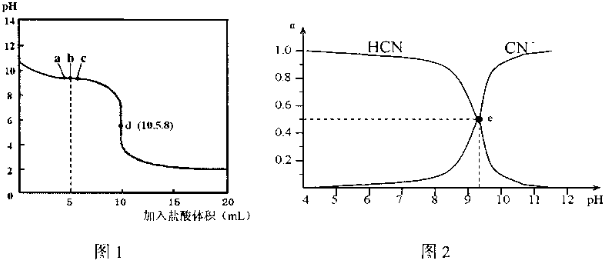
| A. | b点时,溶液中微粒浓度大小的关系:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+) | |
| B. | d点溶液存在的关系:c(Na+)+c(H+)=c(HCN)+c(OH-)+2c(CN-) | |
| C. | 图2中的e点对应图1中的c点 | |
| D. | 在滴定过程中选用酚酞试剂比选用甲基橙试剂作指示剂误差更小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 苯甲酸叶醇酯存在于麝香、百合和水仙花中,可用于高档香水的香精配方中,留香时间超过两周,其结构简式如图所示,下列关于苯甲酸叶醇酯的说法中错误的是( )
苯甲酸叶醇酯存在于麝香、百合和水仙花中,可用于高档香水的香精配方中,留香时间超过两周,其结构简式如图所示,下列关于苯甲酸叶醇酯的说法中错误的是( )| A. | 苯甲酸叶醇酯能发生氧化反应 | |
| B. | 苯甲本叶醇酯能使溴的四氯化碳溶液褪色 | |
| C. | 1mol苯甲酸叶醇酯最多能与4molH2发生加成反应 | |
| D. | 1mol苯甲酸叶醇酯与NaOH溶液反应时,能消耗2molNaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com