
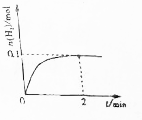
 一定温度下,向2L密闭容器中加入1molNH3(g).发生反应2NH3(g)?3H2(g)+N2(g)△H=+92kJ/mol
一定温度下,向2L密闭容器中加入1molNH3(g).发生反应2NH3(g)?3H2(g)+N2(g)△H=+92kJ/mol分析 (1)由图可知,0~2min内H2物质的量增加0.1mol,结合v=$\frac{△c}{△t}$计算;
(2)若从t1到t2时间段内,反应吸收热量18.4kJ,则分解的氨气为0.4mol,结合v=$\frac{△c}{△t}$计算;
(3)设生成的氢气的物质的量为x,则
2NH3(g)?3H2(g)+N2(g)△n
3 2
x 1.2mol-1mol
x=$\frac{3×(1.2mol-1mol)}{2}$=0.3mol,结合v=$\frac{△c}{△t}$计算;
(4)由反应可知,2mol氨气分解转移6mol电子,则在5min时,转移电子1.5NA,可知分解的氨气为$\frac{2×\frac{1.5{N}_{A}}{{N}_{A}}}{6}$=0.5mol,结合v=$\frac{△c}{△t}$计算;
(5)在8min时,容器内的压强变为原来的1.6倍,设生成氮气为x,则
2NH3(g)?3H2(g)+N2(g)
开始 1 0 0
转化 2x 3x x
8min 1-2x 3x x
则$\frac{1-2x+3x+x}{1}$=1.6,解得x=0.3mol,结合v=$\frac{△c}{△t}$计算.
解答 解:(1)由图可知,0~2min内H2物质的量增加0.1mol,由v=$\frac{△c}{△t}$可知,0~2min内的平均反应速率V(H2)=$\frac{\frac{0.1mol}{2L}}{2min}$=0.025mol/(L.min),
故答案为:0.025mol/(L.min);
(2)若从t1到t2时间段内,反应吸收热量18.4kJ,则分解的氨气为0.4mol,生成氮气为0.2mol,由v=$\frac{△c}{△t}$可知,该时间段内均反应速率V(N2)=$\frac{\frac{0.2mol}{2L}}{{t}_{2}-{t}_{1}}$=$\frac{0.1}{{t}_{2}-{t}_{1}}$mol/(L.min),
故答案为:$\frac{0.1}{{t}_{2}-{t}_{1}}$mol/(L.min);
(3)设生成的氢气的物质的量为x,则
2NH3(g)?3H2(g)+N2(g)△n
3 2
x 1.2mol-1mol
x=$\frac{3×(1.2mol-1mol)}{2}$=0.3mol,
由v=$\frac{△c}{△t}$可知,3min内的平均反应速率V(H2)=$\frac{\frac{0.3mol}{2L}}{3min}$=0.05mol/(L.min),
故答案为:0.05mol/(L.min);
(4)由反应可知,2mol氨气分解转移6mol电子,则在5min时,转移电子1.5NA,可知分解的氨气为$\frac{2×\frac{1.5{N}_{A}}{{N}_{A}}}{6}$=0.5mol,由v=$\frac{△c}{△t}$可知,5min内的平均反应速率V(NH3)=$\frac{\frac{0.5mol}{2L}}{5min}$=0.05mol/(L.min),
故答案为:0.05mol/(L.min);
(5)在8min时,容器内的压强变为原来的1.6倍,设生成氮气为x,则
2NH3(g)?3H2(g)+N2(g)
开始 1 0 0
转化 2x 3x x
8min 1-2x 3x x
则$\frac{1-2x+3x+x}{1}$=1.6,解得x=0.3mol,
由v=$\frac{△c}{△t}$可知,则这8min内的平均反应速率V(N2)=$\frac{\frac{0.3mol}{2L}}{8min}$=0.01875mol/(L.min),
故答案为:0.01875mol/(L.min).
点评 本题考查考查较综合,以物质的量随时间变化、化学平衡计算、氧化还原反应、反应中能量变化为载体考查反应速率计算,为高频考点,把握反应物或生成物的物质的量变化为解答的关键,侧重分析与计算能力的考查,题目难度中等.


 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:实验题
| 实验步骤 | 现象 | 结论 |
| 取少量NaOH溶液样品于试管中,先滴加足量的CaCl2溶液,然后再滴加酚酞试液. | NaOH溶液部分变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol Fe与1mol Cl2反应时转移的电子数目为3NA | |
| B. | 3g C18O和14CO的混合物中所含电子、中子数目为1.4NA | |
| C. | 0℃、101kPa下,0.1mol 乙炔和甲醛(HCHO)的混合物中含有C-H数目为0.2NA | |
| D. | 50ml 18mo•L-1浓H2SO4与足量的Cu充分反应,能收集到SO2的分子数目为0.45NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以煤、石油和天然气为主要原料生产的合成材料是塑料、合成橡胶、合成纤维 | |
| B. | 煤是工业上获得芳香烃的一种重要来源 | |
| C. | 石油的裂解是为了提高轻质油(例如汽油)的产量 | |
| D. | 天然气的主要成分是甲烷,属于不可再生资源 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 离子化合物一定含有离子键 | |
| B. | 共价化合物一定不含离子键 | |
| C. | 只含共价键的物质叫共价化合物 | |
| D. | 化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com