
| A. | Na+、Al3+、HCO3-、NO3- | B. | AlO2-、Cl-、Mg2+、K+ | ||
| C. | NH4+、Na+、CH3COO-、NO3- | D. | Na+、NO3-、Fe3+、I- |
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题

 .(2分)
.(2分)查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | A | B | C |
发 生 装 置 | 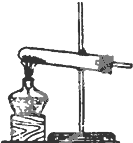 |  | 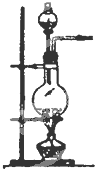 |
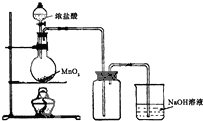
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 研究物质的性质时,常用到观察、实验、分类、比较等方法 | |
| B. | 研究物质性质的一般程序的第一步是预测物质的性质 | |
| C. | 可以用分类的方法预测物质的性质 | |
| D. | 观察是一种有计划、有目的地用感官考察研究对象的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质与非电解质本质区别是在水溶液或熔化状态下能否电离 | |
| B. | 纯碱、烧碱均属于碱 | |
| C. | 电离时能产生H+的化合物,一定是酸 | |
| D. | 非金属氧化物一定是酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量 | 0.255g | 0.385g | 0.459g |
| 气体体积 | 280mL | 336mL | 336mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com