
【题目】关于阿佛加德罗常数(NA)的说法中错误的是( )
A. 等物质的量的CH4和H2O,核外电子总数均为10NA
B. 12克NaHSO4和MgSO4的固体混合物中含阳离子数为0.1NA
C. 反应2NH4ClO4![]() N2↑+Cl2↑+2O2↑+4H2O,每产生1molO2转移电子数为7NA
N2↑+Cl2↑+2O2↑+4H2O,每产生1molO2转移电子数为7NA
D. 100g质量分数为46%C2H5OH溶液中,含氢原子数为12NA
【答案】A
【解析】
A、甲烷和水的物质的量不明确,故等物质的量的两者中含有的电子数相同,但不一定是10NA个,故A错误;
B、NaHSO4和MgSO4的摩尔质量均为120g/mol,12g混合物的物质的量为0.1mol,且两者均由1个阳离子和1个阴离子构成,故0.1mol混合物中含有的阳离子为0.1NA个,故B正确;
C、反应2NH4ClO4![]() N2↑+Cl2↑+2O2↑+4H2O中,氯元素由+7价降为0价,故此反应转移14mol电子,生成2mol氧气,故当生成1mol氧气时,反应转移7NA个电子,故C正确;
N2↑+Cl2↑+2O2↑+4H2O中,氯元素由+7价降为0价,故此反应转移14mol电子,生成2mol氧气,故当生成1mol氧气时,反应转移7NA个电子,故C正确;
D、在乙醇溶液中,除了乙醇外,水也含氢原子,100g质量分数为46%的乙醇溶液中,乙醇的质量为46g,物质的量为1mol,含6NA个H原子;水的质量为54g,物质的量为3mol,含H原子为6NA个,故共含12NA个,故D正确。
故选:A。


科目:高中化学 来源: 题型:
【题目】已知草酸为二元弱酸:H2C2O4![]() HC2O4﹣+ H+ Ka1 ; HC2O4﹣
HC2O4﹣+ H+ Ka1 ; HC2O4﹣![]() C2O42﹣+H+ Ka2,T℃常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4﹣、C2O42﹣三种,微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
C2O42﹣+H+ Ka2,T℃常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4﹣、C2O42﹣三种,微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是

A. T℃时,lgKa2=-4.2
B. pH=1.2溶液中:c(K+)+c(H+)=c(OH﹣)+c(H2C2O4)
C. pH=2.7溶液中:![]()
D. 向pH=1.2的溶液中再加KOH溶液,将pH增大至4.2的过程中水的电离度一直增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酯W是一种疗效明显的血管扩张剂,一种合成流程如下:
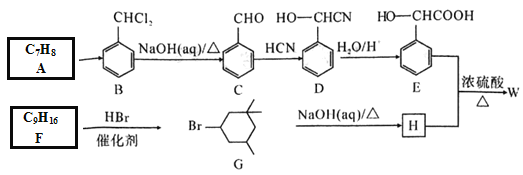
回答下列问题
(1)E中含碳官能团的名称是_______;C的名称是_____。
(2)A→B反应条件和试剂是___________;C→D的反应类型是___________。
(3)写出W的结构简式:___________。能测定H分子中所含化学键和官能团种类的仪器名称是____________。
(4)写出F→G的化学方程式:__________。
(5)R是E的同分异构体R同时具备下列条件的结构有______种
①遇氯化铁溶液发生显色反应; ②能发生水解反应和银镜反应,其中,在核磁共振氢谱上有5组峰且峰的面积比为1:1:2:2:2的结构简式为___________。
(6)以乙醛为原料合成环酯 ,设计合成路线(其他试剂自选):______________。
,设计合成路线(其他试剂自选):______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在容积为 10L 的密闭容器中,1molX 和 1molY 进行如下反应:2X(g)+Y(g)![]() Z(g) 经 60s 达到平衡,生成 0.3molZ,下列说法正确的是
Z(g) 经 60s 达到平衡,生成 0.3molZ,下列说法正确的是
A. 以 X 浓度变化表示的反应速率为 0.001mol/(L·s)
B. 将容器容积变为 20L,Z 的平衡浓度为原来的 1/2
C. 若增大压强,则正反应速率增大,逆反应速率减小
D. 若升高温度,X 的体积分数增大,则该反应的ΔH >0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质与条件已略去)。已知A、B均为由相同的两种元素组成的无色液体,C、E、G、I均为无色气体,其中C为单质,E为最简单的烃,G能使澄清石灰水变浑浊,I能使品红褪色;D、E均由两种元素组成,D的摩尔质量为144g·mol-1,H中两种元素质量比为7∶8,F是白色胶状沉淀,J是红棕色固体。

(1)G的电子式为_____。
(2)H的化学式为_____。
(3)写出反应①的化学方程式:______。
(4)写出反应②的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业的原理改进方法如图分两个阶段进行,下列说法中错误的是( )

A. 在阶段I中,电源a为正极、b为负极
B. 阶段Ⅱ阴极反应:Na0.44-xMnO2+xe-+xNa+=Na0.44MnO2
C. 比传统氯碱工业减少了阳离子交换膜,避免氢气和氯气混合,便于NaOH提纯
D. 阶段Ⅰ,Ⅱ的反应不能都在饱和食盐水的条件下进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在呼吸面具和潜水艇中可用过氧化钠作为供氧剂,请选择适当的化学试剂和实验用品,用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。

(1)A是制取CO2的装置.写出A中发生反应的化学方程式___________________。
(2)填写表中空格:
仪器 | 加入试剂 | 加入该试剂的目的 |
B | 饱和NaHCO3溶液 | 除去二氧化碳中的氯化氢 |
C | ____________ | ____________ |
D | NaOH溶液 | ____________ |
(3)写出C中发生反应的化学方程式:___________________。
(4)试管F中收集满气体后,下一步实验操作是把E中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管,立即把_____________________,则证明试管中收集的气体是氧气。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解足量下列溶液一段时间后,再加入一定量括号内的纯净物,能使溶液恢复到原来的成分和浓度的是
A. AgNO3[AgNO3] B. NaOH[NaOH] C. KCl[H2O] D. CuSO4[CuO]
【答案】D
【解析】石墨电极为惰性电极,溶液中阳离子在阴极放电,阴离子在阳极放电。A、电解AgNO3溶液,Ag+在阴极放电生成Ag,OH-在阳极放电生成O2,且n(Ag)∶n(O2)=2∶1,则应加入Ag2O恢复浓度,故A错误;B、电解NaOH溶液,H+在阴极放电生成H2,OH-在阳极放电生成O2,且n(H2)∶n(O2)=2∶1,则应加入一定量的H2O恢复原样,故B错误;C、电解KCl溶液,H+在阴极放电生成H2,Cl-在阳极放电生成Cl2,且n(H2)∶n(Cl2)=1∶1,则应加入一定量HCl恢复原样,故C错误;D、电解CuSO4溶液,Cu2+在阴极放电生成Cu,OH-在阳极放电生成O2,且n(Cu)∶n(O2)=2∶1,则应加入一定量CuO恢复原样,故D正确。故选D。
点睛:分析电解反应的原理,在两极析出什么物质(固体或气体),相当于什么物质脱离反应体系,根据元素守恒和原子比例,加入对应的物质,即可使溶液完全复原。
【题型】单选题
【结束】
28
【题目】工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是

已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH--4e-=O2↑+2H2O
B. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C. 为了提高Ni的产率,电解过程中需要控制废水pH
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5molL-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述正确的是( )

A.x与y的差值为0.02mol
B.原溶液中c(Cl-)=0.75mol·L-1
C.原溶液的pH=1
D.原溶液中n(Mg2+)∶n(Al3+)=5∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com