
 利用下列反应:Fe+2Fe3+═3Fe2+,设计一个化学电池(给出若干导线和一个小灯泡,电极材料和电解液自选):①画出实验装置图;②注明正负极材料和电解质溶液;③标出电子流动方向.
利用下列反应:Fe+2Fe3+═3Fe2+,设计一个化学电池(给出若干导线和一个小灯泡,电极材料和电解液自选):①画出实验装置图;②注明正负极材料和电解质溶液;③标出电子流动方向.  云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:填空题
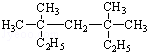 系统命名为3,3,5,5-四甲基庚烷
系统命名为3,3,5,5-四甲基庚烷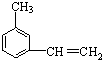
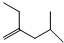 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
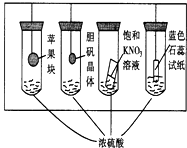
| A. | 苹果块会干瘪 | B. | 胆矾晶体表面有“白斑” | ||
| C. | 小试管内有KNO3晶体析出 | D. | 蓝色石蕊试纸变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 非金属性比硫弱 | B. | 氢化物比HBr稳定 | ||
| C. | 原子序数为34 | D. | 最高价氧化物的水化物显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 装置 | 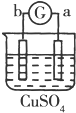 | 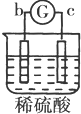 | 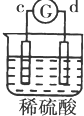 | 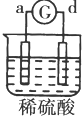 |
| 部分实验现象 | a极质量减小b极质量增加 | c极有气体产生 b极质量减轻 | d极溶解c极有气体产生 | 电流从a极流向d极 |
| A. | a>b>c>d | B. | b>c>d>a | C. | d>a>b>c | D. | a>b>d>c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
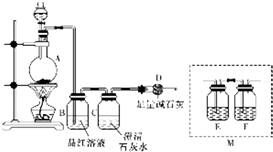 为探究某铁碳合金与浓硫酸在加热条件下反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了如图所示的实验装置,并完成以下实验探究.往圆底烧瓶中加入mg铁碳合金,并滴入过量浓硫酸,点燃酒精灯.
为探究某铁碳合金与浓硫酸在加热条件下反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了如图所示的实验装置,并完成以下实验探究.往圆底烧瓶中加入mg铁碳合金,并滴入过量浓硫酸,点燃酒精灯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
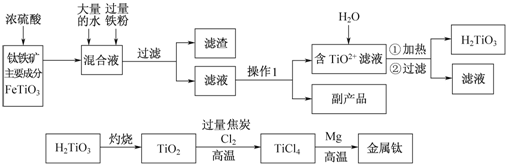
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
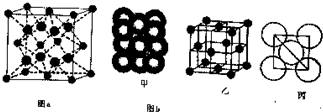
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
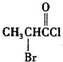 、
、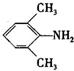 是合成施安卡因(
是合成施安卡因(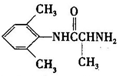 ,一种抗心律失学药物)的中间体,分别由如图所示路线合成:
,一种抗心律失学药物)的中间体,分别由如图所示路线合成: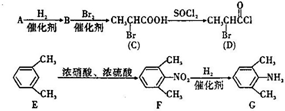 ,已知氨基(-NH2)、亚氨基(-NH-)均有碱性.
,已知氨基(-NH2)、亚氨基(-NH-)均有碱性.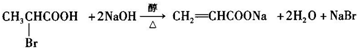 ;
;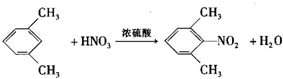 ;
;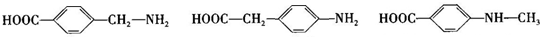 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com