
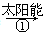 (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2 mCeO2+xH2+xCO
mCeO2+xH2+xCOA.该过程中CeO2没有消耗 |
| B.该过程实现了太阳能向化学能的转化 |
| C.图中ΔH1=ΔH2+ΔH3 |
| D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-=CO32-+2H2O |
科目:高中化学 来源:不详 题型:填空题

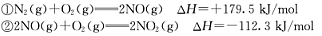


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(g)+H2(g);②C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
CO(g)+H2(g);②C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1
Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1 H+(aq)+OH-(aq) ;ΔH=" b" kJ?mol-1
H+(aq)+OH-(aq) ;ΔH=" b" kJ?mol-1查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OCH3+H2O
CH3OCH3+H2O CH3OCH3(g)+CO2(g) △H=-247kJ/mol
CH3OCH3(g)+CO2(g) △H=-247kJ/mol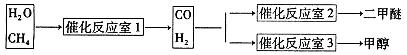
 CH3OCH3(g)+CO2(g)在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是
CH3OCH3(g)+CO2(g)在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是  CH3OH(g)+H2O (g) △H<0反应达到平衡时,改变温度(T)和压强(P),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(P)的关系判断正确的是 (填序号)
CH3OH(g)+H2O (g) △H<0反应达到平衡时,改变温度(T)和压强(P),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(P)的关系判断正确的是 (填序号)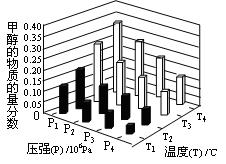
 CO(g)+3H2(g) △H>0写出平衡常数的表达式:
CO(g)+3H2(g) △H>0写出平衡常数的表达式: 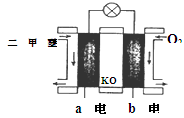
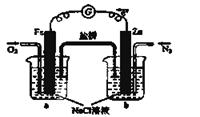
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。


 N2(g)+CO2(g)+2H2O(g) ΔH1="-867" kJ/mol
N2(g)+CO2(g)+2H2O(g) ΔH1="-867" kJ/mol N2O4(g) ΔH2="-56.9" kJ/mol
N2O4(g) ΔH2="-56.9" kJ/mol
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
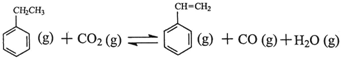 △H
△H △H1=+117.6kJ·mol-1
△H1=+117.6kJ·mol-1 CO (g)+H2O (g) △H2=+41.2kJ·mol-1
CO (g)+H2O (g) △H2=+41.2kJ·mol-1 。
。| A.大于0.5mol/L | B.小于0.5mol/L |
| C.等于0.5mol/L | D.不确定 |
 ,则反应达到平衡时苯乙烯的浓度为 , (均用含
,则反应达到平衡时苯乙烯的浓度为 , (均用含 、P的表达式表示)。
、P的表达式表示)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.△H2-△H1 | B.△H2+△H1 | C.△H1-△H2 | D.-△H1-△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com