
【题目】以冶铝的废弃物铝灰为原料制取超细![]() 氧化铝,既降低环境污染又可提高铝资源的利用率.已知铝灰的主要成分为
氧化铝,既降低环境污染又可提高铝资源的利用率.已知铝灰的主要成分为![]() 含少量杂质
含少量杂质![]() 、FeO、
、FeO、![]() ,其制备实验流程如图1:
,其制备实验流程如图1:
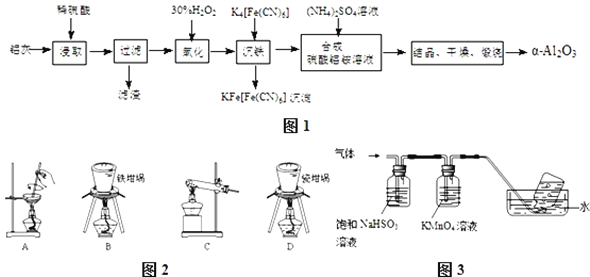
![]() 铝灰中氧化铝与硫酸反应的化学方程式为 ______ .
铝灰中氧化铝与硫酸反应的化学方程式为 ______ .
![]() 用图2中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为 ______
用图2中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为 ______ ![]() 填选项编号
填选项编号![]() .
.
![]() 在实验流程中,加
在实验流程中,加![]() 的
的![]() 溶液发生的离子反应方程式为 ______ .
溶液发生的离子反应方程式为 ______ .
![]() 验证“沉铁”后,溶液中是否还含有铁离子的操作方法为 ______ .
验证“沉铁”后,溶液中是否还含有铁离子的操作方法为 ______ .
![]() 若用调节pH溶液“沉铁”,则得到
若用调节pH溶液“沉铁”,则得到![]() ,已知:
,已知:![]() 时,
时,![]() ,则该温度下反应
,则该温度下反应![]() 的平衡常数为 ______ .
的平衡常数为 ______ .
![]() 煅烧硫酸铝铵晶体,发生的主要反应为:
煅烧硫酸铝铵晶体,发生的主要反应为:![]()
![]()
![]() ,将产生的气体通过图3所示的装置.
,将产生的气体通过图3所示的装置.
①集气瓶中收集到的气体是 ______ ![]() 填化学式
填化学式![]() .
.
②![]() 溶液褪色,发生的离子反应方程式为 ______ .
溶液褪色,发生的离子反应方程式为 ______ .
【答案】![]() B
B ![]() 静置,溶液澄清后,继续向上层清液中滴加
静置,溶液澄清后,继续向上层清液中滴加![]() 溶液,若无现象,则溶液中不含有铁元素,反之,则有
溶液,若无现象,则溶液中不含有铁元素,反之,则有 ![]()
![]()
![]()
【解析】
铝灰的主要成分为![]() 含少量杂质
含少量杂质![]() 、FeO、
、FeO、![]() 加稀硫酸,
加稀硫酸,![]() 、FeO、
、FeO、![]() 转化为离子,
转化为离子,![]() 不溶于硫酸,过滤,滤液中含有
不溶于硫酸,过滤,滤液中含有![]() 、
、![]() 、
、![]() ,加双氧水,
,加双氧水,![]() 被氧化为
被氧化为![]() ,加入
,加入![]() 转化为沉淀,过滤,在滤液中加入硫酸铵,生成
转化为沉淀,过滤,在滤液中加入硫酸铵,生成![]() ,结晶、干燥、煅烧得到
,结晶、干燥、煅烧得到![]() ;
;
(1)![]() 与硫酸反应生成硫酸铝和水;
与硫酸反应生成硫酸铝和水;
(2)蒸发皿不能用来加热固体,瓷坩埚含有二氧化硅和氢氧化钠反应;
(3)加![]() 的
的![]() 溶液
溶液![]() 被氧化为
被氧化为![]() ;
;
(4)三价铁离子遇到![]() 反应生成沉淀,据此设计实验检验是否含铁离子;
反应生成沉淀,据此设计实验检验是否含铁离子;
(5)依据平衡常数的概念结合反应写出计算式计算平衡浓度解答;
(6)①![]() 分解生成的气体
分解生成的气体![]() 和
和![]() 被亚硫酸钠吸收,二氧化硫被高锰酸钾吸收;
被亚硫酸钠吸收,二氧化硫被高锰酸钾吸收;
②![]() 与二氧化硫反应生成硫酸根离子和锰离子。
与二氧化硫反应生成硫酸根离子和锰离子。
铝灰的主要成分为![]() 含少量杂质
含少量杂质![]() 、FeO、
、FeO、![]() 加稀硫酸,
加稀硫酸,![]() 、FeO、
、FeO、![]() 转化为离子,
转化为离子,![]() 不溶于硫酸,过滤,滤液中含有
不溶于硫酸,过滤,滤液中含有![]() 、
、![]() 、
、![]() ,加双氧水,
,加双氧水,![]() 被氧化为
被氧化为![]() ,加入
,加入![]() 转化为沉淀,过滤,在滤液中加入硫酸铵,生成
转化为沉淀,过滤,在滤液中加入硫酸铵,生成![]() ,结晶、干燥、煅烧得到
,结晶、干燥、煅烧得到![]() ;
;
(1)![]() 与硫酸反应生成硫酸铝和水,其反应的方程式为:
与硫酸反应生成硫酸铝和水,其反应的方程式为:![]() ;
;
(2)A.蒸发皿不能用来加热固体,故A不符合;
B.铁坩埚可以熔融二氧化硅和氢氧化钠,故B符合;
C.玻璃中含二氧化硅和氢氧化钠反应,故C不符合;
D.瓷坩埚含有二氧化硅和氢氧化钠反应,故D不符合;
(3)滤液中含有![]() 、
、![]() 、
、![]() ,加
,加![]() 的
的![]() 溶液
溶液![]() 被氧化为
被氧化为![]() ,其反应的离子方程式为:
,其反应的离子方程式为:![]() ;
;
(4)铁离子和铁氰化钾反应产生沉淀,其检验方法是:静置,溶液澄清后,继续向上层清液中滴加![]() 溶液,若无现象,则溶液中不含有铁元素,反之,则有;
溶液,若无现象,则溶液中不含有铁元素,反之,则有;
(5)![]() ,
, ,反应
,反应![]() 的平衡常数
的平衡常数 ;
;
(6)①![]() 分解生成的气体
分解生成的气体![]() 和
和![]() 被亚硫酸钠吸收,二氧化硫被高锰酸钾吸收,所以最后集气瓶中收集到的气体是
被亚硫酸钠吸收,二氧化硫被高锰酸钾吸收,所以最后集气瓶中收集到的气体是![]() ;
;
②酸性条件下,![]() 与二氧化硫反应生成硫酸根离子和锰离子,其反应的离子方程式为:
与二氧化硫反应生成硫酸根离子和锰离子,其反应的离子方程式为:![]() 。
。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】若用AG表示溶液的酸度,其表达式为![]() 。室温下,实验室里用0.1mol·L-1的盐酸滴定10mL0.1mol·L-1MOH溶液,滴定曲线如图所示。下列说法正确的是
。室温下,实验室里用0.1mol·L-1的盐酸滴定10mL0.1mol·L-1MOH溶液,滴定曲线如图所示。下列说法正确的是

A. MOH为强碱
B. C点时加入盐酸的体积等于10mL
C. 若B点加入的盐酸体积为5mL,所得溶液中:c(M+)+2c(H+)=c(MOH)+2c(OH-)
D. 滴定过程中从A点到D点溶液中水的电离程度:A<B<C<D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组探究与铜有关的物质的性质,过程设计如下:
提出猜想:
问题1:在元素周期表中,铜与铝的位置很接近,氢氧化铝具有两性,氢氧化铜有两性吗?
问题2:铁和铜都有变价,一般情况下,Fe2+的稳定性弱于的Fe3+,Cu+的稳定性也弱于Cu2+吗?
问题3:硫酸铜溶液呈蓝色,铜与浓硝酸常温下反应生成的溶液也是蓝色吗?
实验探究:
Ⅰ.解决问题1:
(1)实验需配制100mL0.50molL-1CuSO4溶液,必需的玻璃仪器有胶头滴管、烧杯、___、___。
(2)为达到目的,某同学认为只要进行两次实验即可得出结论。请写出实验②的具体内容。
①向盛有CuSO4溶液的试管中滴加NaOH溶液至过量,观察生成的Cu(OH)2沉淀是否溶解;
②___。
Ⅱ.解决问题2的实验和现象如下:
①取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃时得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;
②取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸,得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验及现象回答下列问题:
(3)写出氧化亚铜与稀硫酸反应的离子方程式:___。
(4)从实验中可得出的结论:当温度在1000℃以上时___(填Cu2+或Cu+,下同)稳定,在酸性溶液中___稳定。
Ⅲ.解决问题3,某同学设计的实验如下:
取一铜片装入试管,加入适量的浓硝酸,观察溶液的颜色变化。
(5)另一同学认为此同学设计的实验有缺陷,原因是___。
(6)铜与浓硝酸反应溶液呈绿色,有同学认为这是生成的NO2溶于其中的原因。请设计实验说明此解释是否正确(只需要写出一种方法即可)。___
实验步骤 | 实验结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关丙烷、丙烯、丙炔说法中正确的有
A.丙烷、丙烯、丙炔的结构式分别为
B.相同物质的量的三种物质完全燃烧,生成的气体在标准状态下,体积比3:2:1
C.丙烷、丙烯、丙炔三种物质的熔沸点逐渐升高,相对条件下密度逐渐增大
D.丙烷的碳原子空间结构是锯齿型的,不是简单的线性排列
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗HIV、抗肿瘤、抗真菌和延缓心血管老化的活性苯并呋喃衍生物(R)的合成路线如下:
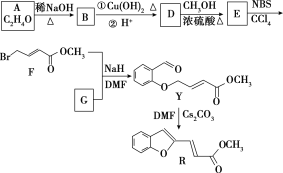
已知:RCHO+R1CH2CHO![]()
![]() +H2O(R、R1表示烃基或氢)
+H2O(R、R1表示烃基或氢)
(1)①A的名称是________。
②D―→E的反应类型是________。
③F中含有的官能团有酯基、________和________(写名称)。
④写出F与足量NaOH溶液共热反应的化学方程式___________。
(2)物质G可通过如下流程合成:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
1.08 g的I与饱和溴水完全反应,生成2.66 g白色沉淀,则I的结构简式为_________写出M―→G中反应①的化学方程式______________________。
(3)下列说法正确的是________(选填字母)。
a.Y易溶于水
b.B能使酸性高锰酸钾溶液褪色
c.R的分子式为C12H10O3
d.I与 互为同系物
互为同系物
(4)写出符合下列要求的E的同分异构体的结构简式:____(写反式结构)。
①与E具有相同官能团 ②能发生银镜反应 ③有2个-CH3 ④存在顺反异构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A.已知2SO2(g)+O22SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B.已知C(石墨,s)=C(金刚石,s) ![]() >0,则金刚石比石墨稳定
>0,则金刚石比石墨稳定
C.已知2C(s)+2O2(g)=2CO2(g) ![]() 1 2C(s)+O2(g)=2CO(g) △H2则△H1<△H2
1 2C(s)+O2(g)=2CO(g) △H2则△H1<△H2
D.已知H+(aq)+OH-(aq)=H2O(l) ![]() =-57.3kJ/mol,则任何酸碱中和的反应热均为57.3kJ
=-57.3kJ/mol,则任何酸碱中和的反应热均为57.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+ O2(g)2SO3(g);H=-196.64kJmol-1,下列说法正确的是( )
A.该反应是吸热反应
B.SO2燃烧热为196.64kJmol-1
C.在容器中充入1molSO2和0.5molO2充分反应,热变化为98.32kJ
D.当有NA个电子发生转移时,热变化为49.16kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后得到CO2和H2O的物质的量随混合烃的总物质的量的变化如图所示,则下列对混合烃的判断正确的是( )
①一定有乙烯;②一定有甲烷;③一定有丙烷;④一定无乙烷;⑤可能有乙烷;⑥可能有丙炔。
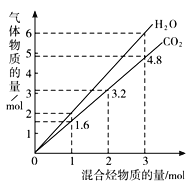
A. ②③⑤B. ⑤⑥C. ①②D. ②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含镍![]() 废料中有FeO、
废料中有FeO、![]() 、MgO、
、MgO、![]() 等杂质,用此废料提取
等杂质,用此废料提取![]() 的工艺流程如图1:
的工艺流程如图1:
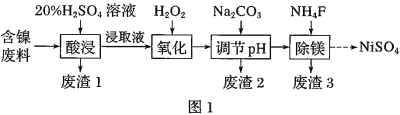

已知:①有关金属离子生成氢氧化物沉淀所需的pH如图.
②![]() 时,
时,![]() 的电离常数
的电离常数![]() 的电离常数
的电离常数![]() ,
,![]()
![]() .
.
(1)加![]() 调节溶液的pH至5,得到废渣2的主要成分是______
调节溶液的pH至5,得到废渣2的主要成分是______![]() 填化学式
填化学式![]() .
.
(2)![]() 能与饱和
能与饱和![]() 溶液反应产生
溶液反应产生![]() ,请用化学平衡移动原理解释
,请用化学平衡移动原理解释![]() 用必要的文字和离子方程式回答
用必要的文字和离子方程式回答![]() ______.
______.
(3)![]() 时,
时,![]() 的NaF溶液中
的NaF溶液中![]() ______
______![]() 列出计算式即可
列出计算式即可![]() 溶液呈______
溶液呈______![]() 填“酸性”、“碱性”或“中性”
填“酸性”、“碱性”或“中性”![]() .
.
(4)已知沉淀前溶液中![]() ,当除镁率达到
,当除镁率达到![]() 时,溶液中
时,溶液中![]() ______
______![]() .
.
(5)在NaOH溶液中用NaClO与![]() 反应可得
反应可得![]() ,化学方程式为____________;
,化学方程式为____________;![]() 与贮氢的镧镍合金可组成镍氢碱性电池
与贮氢的镧镍合金可组成镍氢碱性电池![]() 溶液
溶液![]() ,工作原理为:
,工作原理为:![]() ,负极的电极反应式:______.
,负极的电极反应式:______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com