
| A. | 熔点:SiO2>CsCl>CCl4>CF4 | |
| B. | 离子半径:F->O2->Al3+>Na+ | |
| C. | 酸性强弱:H2SiO3<H2CO3<H2SO3<HNO3 | |
| D. | 碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3 |
分析 A.晶体熔沸点:原子晶体>离子晶体>分子晶体,分子晶体熔沸点与相对分子质量成正比,也受氢键影响;
B.电子层结构相同的离子,离子半径随着原子序数增大而减小;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
D.元素的金属性越强,其最高价氧化物的水化物碱性越强.
解答 解:A.晶体熔沸点:原子晶体>离子晶体>分子晶体,分子晶体熔沸点与相对分子质量成正比,也受氢键影响,SiO2是原子晶体、CsCl是离子晶体、CCl4和CF4是分子晶体,所以熔沸点SiO2>CsCl>CCl4>CF4,故A正确;
B.电子层结构相同的离子,离子半径随着原子序数增大而减小,这几种离子电子层结构相同,原子序数Al>Na>F>O,所以离子半径O2->F->Na+>Al3+,故B错误;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性N>S>C>Si,所以酸性强弱:H2SiO3<H2CO3<H2SO3<HNO3,故C正确;
D.元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性K>Na>Mg>Al,所以碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3,故D正确;
故选B.
点评 本题考查晶体熔沸点高低判断、酸性及碱性强弱判断、离子半径大小比较等知识点,为高频考点,侧重考查元素周期律及性质分析判断能力,知道金属性、非金属性强弱判断方法及常见晶体类型即可解答,注意分子晶体熔沸点高低与化学键无关,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ④⑤⑥⑦ | C. | ①②③⑤⑦⑧ | D. | ①②⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
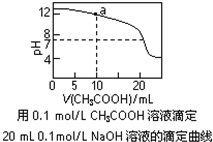
| A. | pH相同的①CH3COONa、②NaHCO3、③Na2CO3三份溶液中的c(Na+):③>②>① | |
| B. | 0.1mol•L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) | |
| C. | 图中pH=7时:c(Na+)>c(CH3COO-)>c(OH-)=c(H+) | |
| D. | 图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2和H2在Pt作用下反应生成NH3 | B. | NH4Cl和Ca(OH)2反应生成NH3 | ||
| C. | NO2和水制硝酸 | D. | 由NH3制氮肥 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 饱和NaCl溶液 | B. | AgNO3 | C. | CuCl2 | D. | 饱和NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 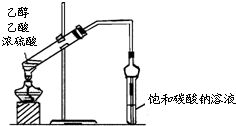 实验室制取乙酸乙酯 | B. | 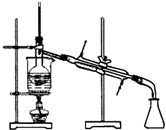 实验室蒸馏石油 | ||
| C. | 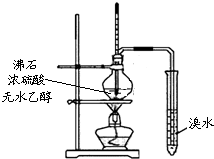 实验室制取乙烯并验证其性质 | D. | 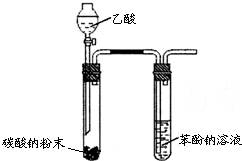 验证乙酸、碳酸、苯酚酸性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向试管内加入水 | |
| B. | 将1mol/L的H2SO4溶液改为1.5mol/L的盐酸 | |
| C. | 将锌片改为锌粉 | |
| D. | 向试管内加少量K2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{2}$(10-8+10-10)mol•L-1 | B. | (10-8+10-10)mol•L-1 | ||
| C. | (1×10-14-5×10-5)mol•L-1 | D. | 2×10-10mo1•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com