考点:晶胞的计算,原子核外电子排布,元素电离能、电负性的含义及应用,化学键,“等电子原理”的应用,原子轨道杂化方式及杂化类型判断,氢键的存在对物质性质的影响
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)根据原子核外电子排布原则:电子优先单独占据1个轨道,且自旋方向相同是,能量最低,根据此原则,O原子核外有8个电子;同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素;
(2)根据杂化轨道数判断杂化类型,杂化轨道数=σ键数+孤对电子对数,据此判断杂质类型,确定分子的空间构型;根据原子数目和电子数目来分析等电子体;
(3)①铜离子含有空轨道,水分子含有孤对电子对,铜离子与水分子之间形成配位键,铜离子配体数为4,1个H
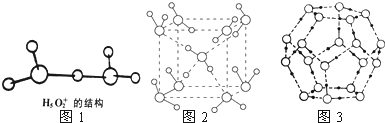
2O含2个O-H键;②根据图1水合盐酸晶体H
5O
2+?Cl
-中H
5O
2+离子的结构解答;
(4)暖冰为分子晶体,暖冰中水分子之间主要的作用力为氢键,电场作用下,水分子间更易制得“暖冰”;
(5)①以立方体中的水分子为研究对象,每个水分子形成4条氢键;每一条氢键连接2个水分子,故冰晶体中氢键数目为水分子数目的2倍;
②五角十二面体是由12个正五边形所组成的正多面体,它共有20个顶点、30条棱、160条对角线;
③以立方体中的水分子为研究对象,每个水分子形成4条氢键,SiO
2空间连接方式与这种冰连接类似;
④设体心立方中晶胞的棱长为X,O-H…O距离为A,则3A
2=(2X)
2,根据体心立方的密度ρ=
计算;
解答:
解:(1)由于简并轨道(能级相同的轨道)中电子优先单独占据1个轨道,且自旋方向相同,原子的能量最低,O原子能量最低排布是
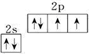
;
同一周期内主族元素的第一电离能从左到右在总体增大的趋势中有些曲折.当外围电子在能量相等的轨道上形成全空、半满或全满结构时,原子的能量较低,元素的第一电离能较大,由于N元素的2p能级3个轨道处于半满,He元素的2P能级3个轨道处于全满,所以它们的第一电离能大小顺序是I
1(He)>I
1(F)>I
1(N)>I
1(O)>I
1(C)>I
1(Be)>I
1(B),
故答案为:

;4;
(2)H
2O中价层电子对个数=2+
(6-2×1)=4,且含有2个孤电子对,所以H
2O的VSEPR模型为四面体,分子空间构型为V型,中心原子杂化方式为sp
3,H
3O
+中O原子的质子数为8,H原子的质子数为1,所以H
3O
+的质子数为11,电子数=11-1=10,NH
3的原子数目为4,电子数目为10,则与H
3O
+互为等电子体,结构式为:

,
故答案为:sp
3;四面体形;

;
(3)①Cu
2+含有空轨道,H
2O含有孤对电子,可形成配位键,铜离子配体数为4,配离子[Cu(H
2O)
4]
2+中1个Cu
2+与4个H
2O形成配位键,1个H
2O含2个O-H键,所以1mol水合铜离子中含有σ键数目为12N
A,
故答案为:12N
A;
②根据图1水合盐酸晶体H
5O
2+?Cl
-中H
5O
2+离子的结构知:a.氢离子含有空轨道,氧原子含有孤电子对,所以能形成配位键;b.O-H形成极性键;c.无非极性键;d.因H
5O
2+中无阴阳离子,所以不存在离子键;
e.因H
5O
2+中无金属所以不存在金属键;f.氢键存在于不直接相连的H与电负性较大的O原子间; g.因H
5O
2+中无分子,所以不存在范德华力;h.因H
5O
2+中无双键或三键,所以不存在π键;i.O-H形成σ键,
故答案为:a b f i;
(4)水分子之间主要通过氢键形成固体,水分子是极性分子,在电场作用下定向有规则的排列,水分子间更易形成氢键,
故答案为:水分子是极性分子,在电场作用下定向有规则的排列,分子间通过氢键结合而成固体;
(5)①晶体冰中,每两个水分子间有一个氢键,平均属于每个水分子有半个,一个水分子与周围的四个水分子以氢键结合,故1mol冰中有2 mol氢键,
故答案为:2;
②冰融化后,在液态水中,全部形成如图3的五角十二面体,五角十二面体顶点数为20,每个水分子形成4条氢键,每两个水分子间有一个氢键,存在氢键总数目为40个,
每一条氢键连接2个水分子,在五角十二面体中有30条棱,所以氢键数为30,则该冰熔化过程中氢键被破坏的百分比为
×100%=25%,
故答案为:25%;
③二氧化硅是原子晶体,Si-O通过共价键形成四面体结构,四面体之间通过共价键形成空间网状结构,以立方体中的水分子为研究对象,每个水分子形成4条氢键,SiO
2空间连接方式与这种冰连接类似,
故答案为:SiO
2;
④体心立方晶胞中水分子个数=1+8×
=2;设体心立方中晶胞的棱长为X,O-H…O距离为A,则3A
2=(2X)
2,体心立方的密度ρ=
=
=1.51;
故答案为:
=1.51;
点评:本题考查较为综合,涉及分子的立体构型、晶胞的计算,氢键、分子结构与杂化理论,题目难度中等,注意晶体类型的有关计算,需要全面掌握基础知识,并能运用分析解决问题.

 ;
; ;4;
;4; ,
, ;
;

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案