
| A. | 三种元素对应的氧化物均为碱性氧化物 | |
| B. | 三者的单质长期放置在空气中均能被腐蚀 | |
| C. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 | |
| D. | 电解AlCl3、FeCl3、CuCl2的混合溶液时,阴极上依次析出Cu、Fe、Al |
分析 A.氧化铝为两性氧化物,不属于碱性氧化物;
B.铝制品表面生成的氧化铝性质稳定,熔点高,起到保护内部金属的作用,铁制品在潮湿的空气中易生锈,铜在潮湿空气中生成铜绿;
C.铝离子、铁离子和铜离子都能够水解生成氢氧化物和氯化氢,加热后水解程度增大,氯化氢挥发,则最终无法得到它们的氯化物;
D.根据电解原理,阴极上析出的金属应按照其对应的阳离子的放电顺序来析出.
解答 解:A.铁和铜对应氧化物为氧化铁、氧化铜都属于碱性氧化物,而铝对应的氧化物Al2O3是两性氧化物,不是碱性氧化物,故A错误;
B.铝表面生成的氧化铝性质稳定,熔点高,起到保护内部金属的作用,铁在潮湿的空气中易生锈,铜在潮湿空气中生成铜绿,铁、铜期放置在空气中均易腐蚀,而铝单质不会被腐蚀,故B错误;
C.因为AlCl3、FeCl3、CuCl2的溶液加热时都水解生成沉淀和HCl气体,HCl挥发,所以得到的是各自的氢氧化物沉淀,故制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法,故C正确;
D.根据电解原理,阴极上离子的放电顺序是:Cu2+>H+>Fe2+>Al3+,Fe2+和Al3+不放电,Fe3+得电子成为Fe2+不会析出铁,所以铁和Al在溶液中不会析出,只有Cu可以,故D错误;
故选C.
点评 本题考查了金属单质及其化合物性质,题目难度中等,涉及盐的水解原理、电解原理、氧化物类型判断等知识,注意掌握常见金属单质及其化合物性质,明确电解原理、碱性氧化物、两性氧化物的概念及判断方法.


科目:高中化学 来源: 题型:解答题
 ,基态原子核外电子排布式1s22s22p63s23p63d24s2.该元素的原子序数为22,该元素是金属元素(填“金属”或“非金属”).
,基态原子核外电子排布式1s22s22p63s23p63d24s2.该元素的原子序数为22,该元素是金属元素(填“金属”或“非金属”).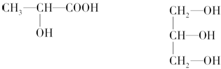
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 配料 | 氯化钠(NaCl)、碘酸钾(KIO3) |
| 含碘量 | 20~40mg•kg-1 |
| 保质期 | 18个月 |
| 食用方法 | 勿长时间炖炒 |
| 贮藏指南 | 避热、避光、密封、防潮 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
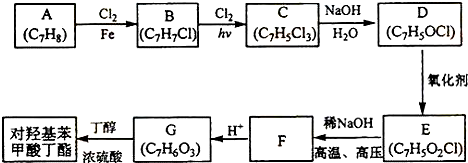
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
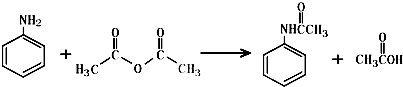
 ,该反应的类型为取代反应;
,该反应的类型为取代反应; ;
;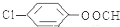 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氨气通入稀硫酸中:NH3+H+═NH4+ | |
| B. | 小苏打溶液和烧碱溶液反应:HCO3-+2OH-═CO32-+H2O | |
| C. | 一小块金属钠投入水中:Na+2H2O═Na++OH-+H2↑ | |
| D. | 澄清石灰水中加入过量硝酸:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
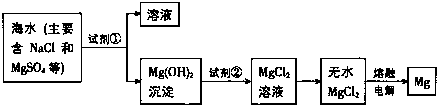
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用移液管移取10 mL NaOH溶液放于锥形瓶中,移液管的尖嘴和锥形瓶内壁一定要接触 | |
| B. | 实验室制硝基苯时,先将硝酸与浓硫酸混合,冷却后边振荡边滴加苯 | |
| C. | 制备硝酸钾晶体实验中先后进行了二次过滤,分别是先常温减压过滤、后高温常压过滤 | |
| D. | 受溴腐蚀致伤:先用苯或甘油洗伤口,再用水洗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com