
| 1.5mol |
| 4mol |
| C(C) 3 |
| C(A)C(B) 2 |
| C(C) 3 |
| C(A)C(B) 2 |


科目:高中化学 来源: 题型:
| O2 |
| 催化剂/△ |
| H2O |
| NaOH |
| 盐酸 |
| 盐酸 |
| 电解 |
| O2 |
| △ |
| CO2 |
| A、②④ | B、③④ | C、①④ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
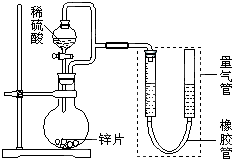 某同学设计了如图所示装置(部分夹持装置已略去)进行实验研究.据此回答下列问题:
某同学设计了如图所示装置(部分夹持装置已略去)进行实验研究.据此回答下列问题:| 序号 | V(H2SO4)/mL | c(H2SO4)/mol?L-1 | t/s |
| Ⅰ | 40 | 1 | t1 |
| Ⅱ | 40 | 4 | t2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、糖类、油脂和蛋白质是基本营养物质 |
| B、蛋白质水解的最终产物是多肽 |
| C、糖尿病人不能食用含糖和淀粉的食品 |
| D、向蛋白质溶液中加入浓的Na2SO4或CuSO4溶液均可使蛋白质盐析而分离提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、容器I、Ⅲ中平衡常数相同 |
| B、容器II、Ⅲ中正反应速率始终相同 |
| C、容器Ⅱ、Ⅲ中的反应达平衡时,SO3的体积分数:II>III |
| D、容器I中SO2的转化率与容器Ⅱ中SO3的转化率之和等于1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丙烷完全燃烧的热化学方程式为C3H8+5O2═3CO2+4H2O△H=-2 036 kJ/mol |
| B、C3H8(g)+5O2(g)═3CO2(g)+4H2O(g);△H<-2 036 kJ/mol |
| C、丙烷完全燃烧的热化学方程式为:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=2 036 kJ/mol |
D、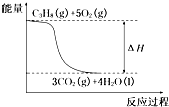 丙烷燃烧的能量变化可用如图所示表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com