

 .
.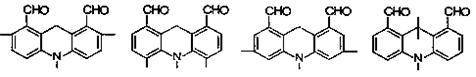 .
. 结构;
结构;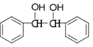 写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)
写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)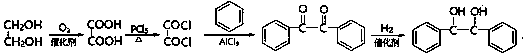 .
. 分析 (1)结合流程图判断出ABCDF中含有的官能团,再确定含有的含氧官能团;
(2)B→C是硝基转化为氨基,是加氢或脱氧反应,由此判断反应类型;
(3)在D→E→F的变化过程中碳架结构不变,碳原子守恒,结合E的分子式推断E的结构简式;
(4)官能团满足的条件为:①能发生银镜反应,说明含有醛基;②含有  结构;③分子中只有6种不同化学环境的氢,说明结构相对对称,由此逐一写出符合条件的同分异构体的结构简式;
结构;③分子中只有6种不同化学环境的氢,说明结构相对对称,由此逐一写出符合条件的同分异构体的结构简式;
(5)以苯和乙二醇为原料制备1,2-二苯基乙二醇 ,可利用乙二醇催化氧化为乙二酸,再根据题中信息在PCl3的作用下生成COClCOCl,再与苯发生取代反应,最后再加氢还原即可.
,可利用乙二醇催化氧化为乙二酸,再根据题中信息在PCl3的作用下生成COClCOCl,再与苯发生取代反应,最后再加氢还原即可.
解答 解:(1)结合流程图中A、B、C、D、F的结构简式可知,在A、B、C、D、F中中的含氧官能团名称为硝基、羰基;故答案为:硝基;羰基;(2)B→C是将硝基还原为氨基,发生的反应类型为还原反应,故答案为:还原反应;
(3)根据D→E的反应物是C2H5Cl与 ,并结合F的结构简式和E的分子式为C14H13N,可知E的结构简式为
,并结合F的结构简式和E的分子式为C14H13N,可知E的结构简式为  ;故答案为
;故答案为 :;
:;
(4)①能发生银镜反应,可知结构中含有醛基;②含有 结构;③分子中只有6种不同化学环境的氢,可知结构具有一定的对称性;则符合条件的F的一种同分异构体的结构简式可能为
结构;③分子中只有6种不同化学环境的氢,可知结构具有一定的对称性;则符合条件的F的一种同分异构体的结构简式可能为  ,
,
故答案为: ;
;
(5)以苯和乙二醇为原料制备1,2-二苯基乙二醇 的合成路线流程图为
的合成路线流程图为 ,
,
故答案为: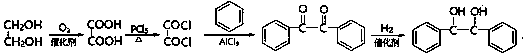 .
.
点评 结合有机合成流程,推断多官能团有机物的结构、性质及符合条件的同分异构体的书写,综合性较强,难点是根据要求设计合成路线,对学生综合利用信息的能力要求较高.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铝和氧化铁在高温下反应制取铁 | B. | 用溴和碘化钾溶液反应制取碘 | ||
| C. | 用碳和高温水蒸汽反应制取氢气 | D. | 用氢气和灼热的氧化铜反应制取铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2(HCl)用NaOH溶液 | B. | Na2CO3(NaHCO3)用HCl溶液 | ||
| C. | NaCl溶液(I2)用CCl4 | D. | FeCl2(FeCl3)通入Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)事实证明,能设计成原电池的反应通常是放热反应.下列化学反应在理论上可以设计成原电池的是B.
(1)事实证明,能设计成原电池的反应通常是放热反应.下列化学反应在理论上可以设计成原电池的是B.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度(℃) 溶解度(g) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+的数目为NA | B. | OH-的物质的量为1mol | ||
| C. | Na+的物质的量浓度为1mol/L | D. | NaOH的质量为40g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Z | |
| X | Y |
| A. | Z元素的最高正化合价,一定等于其主族序数 | |
| B. | 它们的原子半径由大到小的顺序一定是Y>X>Z | |
| C. | 若它们的原子最外层电子数之和为11,则它们均为非金属元素 | |
| D. | 若它们均为非金属元素,则X与氧元素组成的物质一定是酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用石墨作电极电解AlCl3溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | H2S的电离方程式为 H2S+H2O?HS-+H3O+ | |
| C. | 用铁做电极电解饱和食盐水的阳极反应式:Fe-2e-═Fe2+ | |
| D. | 用两个铜片作电极电解盐酸:Cu+2H+ $\frac{\underline{\;电解\;}}{\;}$H2↑+Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com