
分析 (1)加热条件下,Cu和稀硫酸、氧气发生氧化还原反应生成硫酸铜和水,根据反应物、生成物和反应条件书写方程式;
(2)无水硫酸铜固体是白色、五水硫酸铜晶体是蓝色;
(3)硫酸根离子中S原子价层电子对个数是4且不含孤电子对,根据价层电子对互斥理论确定硫酸根离子空间构型及S原子杂化方式;
(4)根据Cu原子结构知,Au原子最外层为第6电子层,且最外层只有一个电子;
一种铜合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,该合金中每一层均为密置层,Au原子配位数=3×8÷2;该晶体是由金属晶体,原子之间存在金属键;
(5)该晶体储氢后的晶胞结构与CaF2的晶胞结构结构相似,则在金属晶胞内部有8个H原子,该晶胞中含有1个Au原子、3个Cu原子,据此判断其化学式;
若Cu原子与Au原子的距离为a cm,则晶胞棱长=$\sqrt{2}$acm,晶胞体积=($\sqrt{2}$acm)3,晶胞密度=$\frac{\frac{M}{{N}_{A}}}{V}$.
解答 解:(1)加热条件下,Cu和稀硫酸、氧气发生氧化还原反应生成硫酸铜和水,根据反应物、生成物和反应条件书写方程式为2Cu+O2+2H2SO4(稀) $\frac{\underline{\;△\;}}{\;}$2CuSO4+2H2O,故答案为:2Cu+O2+2H2SO4(稀) $\frac{\underline{\;△\;}}{\;}$2CuSO4+2H2O;
(2)无水硫酸铜固体是白色、五水硫酸铜晶体是蓝色,所以无水硫酸铜吸水后固体由白色变为蓝色,故答案为:白色粉末变成蓝色晶体;
(3)硫酸根离子中S原子价层电子对个数是4且不含孤电子对,根据价层电子对互斥理论确定硫酸根离子空间构型为正四面体,S原子杂化方式为sp3;
故答案为:正四面体,sp3;
(4)根据Cu原子结构知,Au原子最外层为第6电子层,且最外层只有一个电子,其最外层电子排布式为6s1;
一种铜合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,该合金中每一层均为密置层,Au原子配位数=3×8÷2=12;该晶体是由金属晶体,原子之间存在金属键;
故答案为:6s1;密置层;12;金属键;
(5)该晶体储氢后的晶胞结构与CaF2的晶胞结构结构相似,则在金属晶胞内部有8个H原子,该晶胞中含有Au原子个数=8×$\frac{1}{8}$=1、Cu原子个数=6×$\frac{1}{2}$=3,据此判断其化学式为H8AuCu3;
若Cu原子与Au原子的距离为a cm,则晶胞棱长=$\sqrt{2}$acm,晶胞体积=($\sqrt{2}$acm)3,晶胞密度=$\frac{\frac{M}{{N}_{A}}}{V}$=$\frac{\frac{397}{{N}_{A}}}{2\sqrt{2}{a}^{3}}$g/cm3,
故答案为:H8AuCu3;$\frac{397}{2\sqrt{2}NAa3}$g/cm3.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、原子核外电子排布、原子杂化、空间构型判断、氧化还原反应等知识点,侧重考查学生分析计算能力,难点是晶胞计算,注意密度公式中各个字母含义,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(OH-)>c(HS-)>c(S2-)>c(H+) | B. | c(Na+)>c(HS-)>c(H+)>c(S2-)>c(OH-) | ||
| C. | c(Na+)>c(HS-)>c(OH-)>c(H+)>c(S2-) | D. | c(Na+)>c(HS-)>c(OH-)>c(S2-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C被还原 | B. | C发生氧化反应 | C. | ZnCO3被氧化 | D. | ZnCO3是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直径介于1~100 nm之间的粒子称为胶体 | |
| B. | 电泳现象可证明胶体带电 | |
| C. | 1 mol•L-1的硫酸钠溶液和1 mol•L-1的氢氧化钠溶液,分别做导电性实验,两种溶液的导电性不同 | |
| D. | 氢氧化铁胶体能导电,故氢氧化铁胶体是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
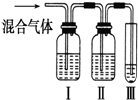 为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先用乙醇和浓硫酸为原料制取乙烯,将生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应.乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量有还原性的杂质气体,由此他提出必须先把杂质气体除去,再与溴水反应.
为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先用乙醇和浓硫酸为原料制取乙烯,将生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应.乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量有还原性的杂质气体,由此他提出必须先把杂质气体除去,再与溴水反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com