
| A. | 丙烷分子的比例模型示意图为 | |
| B. | 按系统命名法,(CH3)2CHCH(CH3)CH=CH2的名称为2,3-二甲基-4-戊烯 | |
| C. | 乙烯的结构简式:C2H4 | |
| D. | 乙醇的最简式:C2H6O |
分析 A.比例模型应该体现出分子中各原子的体积相对大小,题中为丙烷的球棍模型;
B.烯烃的命名选取距离碳碳双键最近的一端命名为1号碳;
C.乙烯的结构简式中没有标出其官能团碳碳双键;
D.最简式表示的是分子中各种元素的最简整数比.
解答 解:A. 为丙烷的球棍模型,丙烷的比例模型为:
为丙烷的球棍模型,丙烷的比例模型为: ,故A错误;
,故A错误;
B.2,3-二甲基-4-戊烯,链端选取错误,正确命名为:2,3-二甲基-1-戊烯,故B错误;
C.乙烯分子中含有碳碳双键,乙烯正确的结构简式为:CH2=CH2,故C错误;
D.乙醇的最简式就是其分子式,故D正确;故选D.
点评 本题考查了比例模型与球棍模型、最简式、烯烃的命名、结构简式的表示方法,题目难度中等,注意掌握常见的化学用语的表示方法,明确球棍模型与比例模型的表示方法.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:解答题
 波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.胆矾CuSO4?5H2O可写成[Cu(H2O)4]SO4?H2O,其结构示意图如图:
波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.胆矾CuSO4?5H2O可写成[Cu(H2O)4]SO4?H2O,其结构示意图如图: ,与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有K、Cr(填元素符号).
,与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有K、Cr(填元素符号).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把金属铁放入稀硫酸中 2Fe+6H+=2Fe3++3H2↑ | |
| B. | 向Ca(ClO)2溶液中通入二氧化硫 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO | |
| C. | 向Ca(HCO3)2溶液中加入足量的氢氧化钠溶液 Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| D. | 向NH4HSO4稀溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全:NH4++H++SO42-+Ba2++2OH-=NH3•H2O+BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
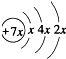 .B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
.B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: ,这样排布遵循了泡利原理和洪特规则.
,这样排布遵循了泡利原理和洪特规则.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
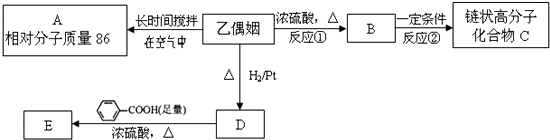
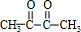
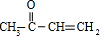 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$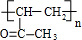
 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$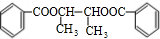 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| B. | 常温常压下,7.8gNa2S和Na2O2固体中含有的阴离子总数为0.1NA | |
| C. | 5.6gFe与标准状况下2.24L氯气充分反应失去电子数为0.3NA | |
| D. | 标准状态下,33.6L氟化氢中含有氟原子的数目为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3、FeSO4;Fe2(SO4)3、Fe(NO3)3、N2O | B. | Fe2(SO4)3、N2O;FeSO4、HNO3、Fe(NO3)3 | ||
| C. | HNO3、Fe2(SO4)3;FeSO4、Fe(NO3)3、N2O | D. | FeSO4、Fe(NO3)3;Fe2(SO4)3、HNO3、N2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10℃时,0.1mol/L Na2S2O3和0.1mol/L H2SO4各5mL | |
| B. | 20℃时,0.1mol/L Na2S2O3和0.1mol/L H2SO4各5mL | |
| C. | 10℃时,0.1mol/L Na2S2O3和0.1mol/L H2SO4各5mL,加水10mL | |
| D. | 20℃时,0.2mol/L Na2S2O3和0.1mol/L H2SO4各5mL,加水10mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com