
| A. | Rb与冷水反应比K更剧烈 | B. | Rb投入CuSO4溶液中可置换出Cu | ||
| C. | Rb与O2反应只有Rb2O产生 | D. | Rb2CO3难溶于水 |
分析 铷元素(Rb)位于元素周期表中第五周期第ⅠA族,为碱金属元素,同主族从上到下金属性增强,同主族元素化合物的性质相似,以此来解答.
解答 解:A.金属性Rb>K,则Rb与冷水反应比K更剧烈,故A正确;
B.Rb投入CuSO4溶液中,先与水反应生成RbOH和氢气,RbOH与硫酸铜发生复分解反应,不能置换出Cu,故B错误;
C.Rb与O2反应生成过氧化物或超氧化物,故C错误;
D.碱金属的碳酸盐易溶于水,则Rb2CO3溶于水,故D错误;
故选A.
点评 本题考查位置、结构与性质,为高频考点,把握元素在周期表的位置、元素周期律为解答的关键,侧重分析与应用能力的考查,注意同主族元素化合物的性质,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 方案 | 目的 |
| A | 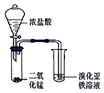 | 验证氧化性::Cl2>Br2 |
| B |  | 验证溶解度:AgCl>Ag2S |
| C | 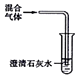 | 检验SO2、CO2混合气体中有CO2 |
| D | 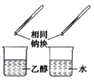 | 比较乙醇中羟基氢原子和水分子中氢原子的活泼性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅可用来制造太阳能电池 | |
| B. | 需要加热才能进行的反应一定是吸热反应 | |
| C. | 铜的金属性比铝弱,可以用铜罐贮运浓硝酸 | |
| D. | NaOH溶液不能保存在带磨口玻璃塞的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀H2SO4 | B. | 稀盐酸 | C. | K2SO4固体 | D. | KNO3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
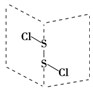 二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )
二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )| A. | S2Cl2的空间构型与H2O2相似 | |
| B. | S2Cl2为含有极性键和非极性键的极性分子 | |
| C. | S2Br2与S2Cl2结构相似,熔沸点:S2Br2<S2Cl2 | |
| D. | S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O═SO2↑+3S↓+4HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol D2O分子所含的中子数为8NA | |
| B. | 48 g氧气和臭氧的混合气体中的氧原子数为3NA | |
| C. | 11.2 L 甲烷(CH4)中的共价键数为2NA | |
| D. | 1 mol N2与3 mol H2反应生成的NH3分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
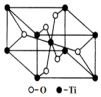 钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:
钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com