
| A、摩尔是国际单位制中的七个物理量之一 |
| B、摩尔是物质的量的单位,简称摩,符号为mol |
| C、氧气的摩尔质量为32g |
| D、每摩尔任何物质均含有6.02×1023个原子 |


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
| A、含大量Al3+的溶液中:K+、Na+、NO3-、S2- |
| B、含大量AlO2-的溶液中:Na+、K+、NO3-、H+ |
| C、含大量H+的溶液中:I-、Cl-、NO3-、Na+ |
| D、含大量OH-的溶液中:CO32-、Cl-、F-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1g氢气在氧气中完全燃烧生成气态水,放出热量120.9kJ,氢气的燃烧热大于241.8kJ?mol-1 | |||
B、500℃30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)
| |||
| C、常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |||
| D、已知中和热为-57.3 kJ?mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量要大于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
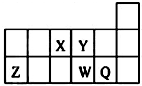 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法不正确的是( )
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法不正确的是( )| A、元素X与元素Z的最高正化合价之和的数值等于8 |
| B、Z的氧化物能与水反应 |
| C、离子Y2-和Z3+的核外电子数和电子层数都相同 |
| D、元素Y的氢化物的稳定性比W的氢化物强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24L C6H14中含有的共用电子对数为1.9NA |
| B、同温同压下,原子数均为NA的氢气和氦气具有相同的体积 |
| C、0.50mol的亚硫酸钠中含有的钠离子数为NA |
| D、常温下,7.1gCl2与足量NaOH溶液作用,转移电子的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHSO3溶液中投入过氧化钠粉末:4HSO3-+2Na2O2═4SO32-+O2↑+4Na+ |
| B、Na2O2与水反应:2O22-+2H2O═4OH-+O2↑ |
| C、向FeBr2溶液中通入少量Cl2:2Fe2++Cl2═2Fe3++2Cl- |
| D、向次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,PH=9的碳酸钠溶液中由水电离出的c(OH-)=1×10-9mol?L-1 |
| B、温度相同时,在弱酸溶液和强碱稀溶液中,水的离子积常数Kw相同 |
| C、将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| D、中和等体积pH相同的H2SO4和HCl溶液,消耗NaOH的物质的量为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
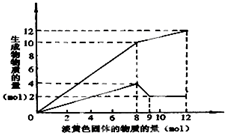 某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.请填写下列空白:
某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸或碱 | 电离平衡常数(Ka或Kb) |
| CH3COOH | 1.7×10-5mol?L-1 |
| HNO2 | 7.1×10-4mol?L-1 |
| HCN | 6.2×10-10mol?L-1 |
| HClO | 4.7×10-8mol?L-1 |
| NH3?H2O | 1.7×10-5mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com