
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
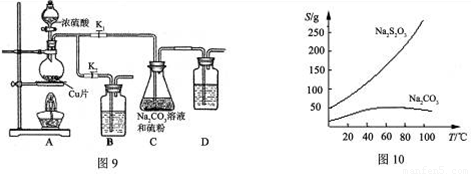
(15分)硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图9。
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图10所示。
(1)Na2S2O3·5H2O的制备:
步骤1:打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热。写出烧瓶内发生反应的化学方程式: 。
步骤2:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH 时,打开K2、关闭K1并停止加热,理由是 。装置B、D的作用是 。
步骤3:过滤C中的混合液,将滤液经过 、 、过滤、洗涤、烘干,得到产品。
(2)Na2S2O3性质的检验:
向新制氯水中加入Na2S2O3溶液,氯水颜色变浅,再向溶液中滴加硝酸银溶液,观察到有白色沉淀产生,据此认为Na2S2O3具有还原性。该方案是否正确并说明理由 。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00 mL。部分反应的离子方程式为①Cr2O72- + 6I-+ 14H+ 2Cr3++3I2+7H2O;②I2+ 2S2O32- 2I-+ S4O62-。
则该废水中Ba2+的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源:2012届江苏省苏北四市(徐、连、淮、宿)高三元月调研测试化学试卷 题型:实验题
(15分)硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图9。
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图10所示。
(1)Na2S2O3·5H2O的制备:
步骤1:打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热。写出烧瓶内发生反应的化学方程式: 。
步骤2:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH 时,打开K2、关闭K1并停止加热,理由是 。装置B、D的作用是 。
步骤3:过滤C中的混合液,将滤液经过 、 、过滤、洗涤、烘干,得到产品。
(2)Na2S2O3性质的检验:
向新制氯水中加入Na2S2O3溶液,氯水颜色变浅,再向溶液中滴加硝酸银溶液,观察到有白色沉淀产生,据此认为Na2S2O3具有还原性。该方案是否正确并说明理由 。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00 mL。部分反应的离子方程式为①Cr2O72-+ 6I-+ 14H+ 2Cr3++3I2+7H2O;②I2+ 2S2O32- 2I-+ S4O62-。
则该废水中Ba2+的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省苏北四市(徐、连、淮、宿)高三元月调研测试化学试卷 题型:实验题
(15分)硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图9。
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图10所示。
(1)Na2S2O3·5H2O的制备:
步骤1:打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热。写出烧瓶内发生反应的化学方程式: 。
步骤2:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH 时,打开K2、关闭K1并停止加热,理由是 。装置B、D的作用是 。
步骤3:过滤C中的混合液,将滤液经过 、 、过滤、洗涤、烘干,得到产品。
(2)Na2S2O3性质的检验:
向新制氯水中加入Na2S2O3溶液,氯水颜色变浅,再向溶液中滴加硝酸银溶液,观察到有白色沉淀产生,据此认为Na2S2O3具有还原性。该方案是否正确并说明理由 。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00
mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00 mL。部分反应的离子方程式为①Cr2O72- + 6I-+ 14H+ 2Cr3++3I2+7H2O;②I2+ 2S2O32- 2I-+ S4O62-。
则该废水中Ba2+的物质的量浓度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com