
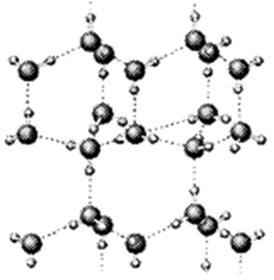
| 化学键 | F—D | F—F | B—B | F—B | C═D | D═D |
| 键能/kJ·mol-1 | 460 | 176 | 347.7 | 347 | 745 | 497.3 |
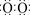 ]2-Na+ (2)①acb ②正四面体 ③-990.7kJ/mol (每空2分)
]2-Na+ (2)①acb ②正四面体 ③-990.7kJ/mol (每空2分)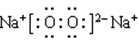 。
。

科目:高中化学 来源:不详 题型:单选题
| A.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增加而升高 |
| B.HF、HCI、HBr、HI的热稳定性依次减弱 |
| C.0℃时,水的密度比冰大 |
| D.水加热到很高的温度都难以分解 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.水很稳定(1000℃以上才会部分分解),但与水中含有大量氢键无关 |
| B.[Cu(NH3)4]SO4和(NH4)2SO4两种物质中都有配位键,所以都是配合物 |
| C.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 |
| D.由下图知酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数大于次氯酸的非羟基氧原子数 |
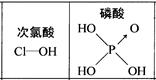
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NF3是离子化合物 | B.NF3的还原性比NH3强 |
| C.NF3的氧化性比F2强 | D.NF3中的N呈+3价 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.若X的原子序数是m,则Y的原子序数必定是m 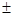 4 4 |
| B.XY3晶体一定属于离子晶体 |
| C.X与Y可属于两个不同周期,也可属于同一周期 |
| D.X的原子半径小于Y的原子半径 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.CH4和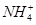 是等电子体,键角均为60° 是等电子体,键角均为60° |
| B.B3N3H6和苯是等电子体,1molB3N3H6和苯均有6mol非极性键 |
| C.NH3和PCl3是等电子体,均为三角锥形结构 |
D.BF3和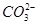 是等电子体,均为平面正三角形结构 是等电子体,均为平面正三角形结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com