
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||

| ||
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
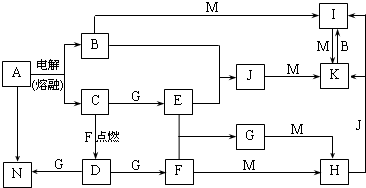
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
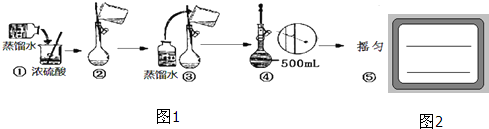
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达到平衡状态时A的转化率为50% |
| B、x=4 |
| C、达到平衡状态时容器内气体的压强与起始时压强比为6:5 |
| D、5s内B的反应速率v(B)=0.05 mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气通过盛有酸性KMnO4溶液的洗气瓶 |
| B、通过装有过量溴水的洗气瓶 |
| C、混合气与足量溴蒸气混合 |
| D、混合气与过量氢气混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,17g甲基(-14CH3)所含的中子数为9NA |
| B、pH=1的稀硫酸中含有的H+数为0.1NA |
| C、7.8g过氧化钠与足量二氧化碳反应转移的电子数为0.1NA |
| D、3molNO2和足量H2O反应,转移1NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中的PH值都增大 |
| B、溶液的导电能力都减弱 |
| C、加水稀释时,KW不变;加CH3COONa晶体时,KW增大 |
| D、加水稀释时,醋酸溶液中所有微粒浓度都减小(不考虑水分子浓度) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com