
| A、a=-23.1kJα=40% |
| B、a=-23.1kJ α=25% |
| C、a=+23.1kJα=40% |
| D、a=+23.1kJ α=25% |
| 2x |
| (1-x)+(3-3x)+2x |
| 0.5mol |
| 2mol |


科目:高中化学 来源: 题型:
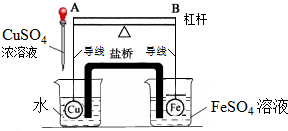
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| c(H2)c(CO) |
| c(H2O) |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1:1 |
| B、1:2:3 |
| C、2:3:6 |
| D、6:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、天然蛋白质水解的最终产物是多种α-氨基酸 |
| B、所有蛋白质遇到硝酸后加热都会变黄 |
| C、蛋白质盐析是可逆的物理过程,利用该性质可提纯和分离蛋白质 |
| D、肥皂液、淀粉液、蛋白质溶液都可以产生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O2 |
| H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com