
|
在反应 :C(s)+CO2(g)①增大压强 ②升高温度 ③通入CO2 ④增加碳的量 ⑤降低压强 | |
| [ ] | |
A. |
①②③ |
B. |
②③④⑤ |
C. |
①②③④ |
D. |
②③④ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| T/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
| K1 |
| K2 |
| K1 |
| K2 |
| 各物质某一状态时的物质的量浓度/mol?L-1 | ||||||
| c(CO2) | c(H2 ) | c(CO) | c(H2O ) | Qc | 平衡 | |
| ① | 0.004 | 0.004 | 0.006 | 0.006 | 已达平衡 | |
| ② | 0.062 | 0.084 | 0.039 | 0.279 | 2.09 | |
| ③ | 0.182 | 0.086 | 0.098 | 0.359 | 2.25 | |
| ④ | 0.078 | 0.142 | 0.280 | 0.120 | 平衡逆向移动 | |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省、汝城县第一中学高三11月联考化学试卷(解析版) 题型:填空题
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。回答下列问题:

(1)在反应②中,每生成 2.24L 气体G(标准状况)时,该反应转移电子的物质的量是 mol。
(2)若反应①在加热条件下进行,单质A和化合物B按物质的量之比为1:2发生反应,且C、D是两种均能使澄清的石灰水变浑浊的无色气体,则反应①的化学方程式是 。
(3)若反应①在溶液中进行,A是一元强碱,B是一种酸式盐,D是一 种使湿润红色石蕊试纸变蓝的气体,且B遇盐酸能生成使品红溶液褪色的气体。在加热条件下,当A过量时,反应①的离子方程式是 。
( 4)由金红石(TiO2)制取单质Ti,涉及到的步骤为:TiO2→TiCl4 Ti
Ti
①C(s) + O2(g) = CO2(g); △H = -393.5 kJ•mol-1
②2CO(g) + O2(g) = 2CO2(g); △H = -566 kJ•mol-1
③TiO2(s) + 2Cl2(g) = TiCl4(s) + O2(g); △H = +141 kJ•mol-1
则TiO2(s) + 2Cl2(g) + 2C(s)= TiCl4(s) + 2CO(g) 的△H = _________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省、汝城县第一中学高三11月联考化学试卷(解析版) 题型:填空题
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。回答下列问题:

(1)在反应②中,每生成 2.24L 气体G(标准状况)时,该反应转移电子的物质的量是 mol。
(2)若反应①在加热条件下进行,单质A和化合物B按物质的量之比为1:2发生反应,且C、D是两种均能使澄清的石灰水变浑浊的无色气体,则反应①的化学方程式是 。
(3)若反应①在溶液中进行,A是一元强碱,B是一种酸式盐,D是一 种使湿润红色石蕊试纸变蓝的气体,且B遇盐酸能生成使品红溶液褪色的气体。在加热条件下,当A过量时,反应①的离子方程式是 。
( 4)由金红石(TiO2)制取单质Ti,涉及到的步骤为:TiO2→TiCl4 Ti
Ti
①C(s) + O2(g) = CO2(g); △H = -393.5 kJ•mol-1
②2CO(g) + O2(g) = 2CO2(g); △H = -566 kJ•mol-1
③TiO2(s) + 2Cl2(g) = TiCl4(s) + O2(g); △H = +141 kJ•mol-1
则TiO2(s) + 2Cl2(g) + 2C(s)= TiCl4(s) + 2CO(g) 的△H = _________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省、汝城县第一中学高三11月联考化学试卷(解析版) 题型:填空题
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。回答下列问题:

(1)在反应②中,每生成 2.24L 气体G(标准状况)时,该反应转移电子的物质的量是 mol。
(2)若反应①在加热条件下进行,单质A和化合物B按物质的量之比为1:2发生反应,且C、D是两种均能使澄清的石灰水变浑浊的无色气体,则反应①的化学方程式是 。
(3)若反应①在溶液中进行,A是一元强碱,B是一种酸式盐,D是一 种使湿润红色石蕊试纸变蓝的气体,且B遇盐酸能生成使品红溶液褪色的气体。在加热条件下,当A过量时,反应①的离子方程式是 。
( 4)由金红石(TiO2)制取单质Ti,涉及到的步骤为:TiO2→TiCl4 Ti
Ti
①C(s) + O2(g) = CO2(g); △H = -393.5 kJ•mol-1
②2CO(g) + O2(g) = 2CO2(g); △H = -566 kJ•mol-1
③TiO2(s) + 2Cl2(g) = TiCl4(s) + O2(g); △H = +141 kJ•mol-1
则TiO2(s) + 2Cl2(g) + 2C(s)= TiCl4(s) + 2CO(g) 的△H = _________________。
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
 2NH3(g);△H=-92.2 kJ/mol。
2NH3(g);△H=-92.2 kJ/mol。
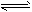 H2(g) +CO(g);△H=+131.3 kJ/mol
H2(g) +CO(g);△H=+131.3 kJ/mol  H2(g)+I2(g)达到平衡后,平衡时I2的浓度c(I2)A____c(I2)B;平衡时HI的分解率
H2(g)+I2(g)达到平衡后,平衡时I2的浓度c(I2)A____c(I2)B;平衡时HI的分解率查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com