
【题目】短周期元素A、B、C、D、E的原子序数依次增大,其中B和E同主族。A元素的最高正价和最低负价的绝对值之差为2;1molC单质能与冷水反应。在标准状况下生成11.2LH2;D原子最外层电子数等于其周期序数;E-的电子层结构与Ar原子相同。
(1)D原子结构示意图为______________,B和C形成的化合物电子式为______________。
(2)B和D简单离子的半径大小为______________。(用离子符号和“>”、“=”或“<”表示)
(3)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是________ (填序号)。
①比较两种单质的颜色 ②比较氢化物的稳定性 ③依据两元素在周期表的位置
④比较原子半径大小 ⑤比较最高价氧化物对应水合物的酸性
(4)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1∶3,相对分子质量为120.5。则该物质的结构式为__________________________。
(5)关于单质C与冷水反应,下列说法正确的是______________。
①单质C熔化成闪亮的小球,说明该反应是放热反应
②生成H2中含有水蒸汽,液态水变成气态水是吸热反应
③该反应是氧化还原反应,所有氧化还原反应都是放热反应
【答案】 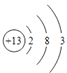
![]() r(F-)>r(Al3+) ①⑤
r(F-)>r(Al3+) ①⑤ ![]() (或
(或 ) ①
) ①
【解析】短周期元素A、B、C、D、E的原子序数依次增大,E-的电子层结构与Ar原子相同,则E为Cl元素,B和E同主族,故B为F元素,1molC单质能与冷水反应,在标准状况下生成11.2LH2,氢气的物质的量为11.2L÷22.4L/mol=0.5mol,故C的价电子数为0.5×2=1,处于第ⅠA族,原子序数大于F元素,故C为Na元素,A元素的最高正价和最低负价的绝对值之差为2,A最外层电子数为5,原子序数小于F原子,故A为N元素;D的原子序数大于钠,D原子最外层电子数等于其周期序数,则D为Al。
(1)D为Al,原子结构示意图为 ;B和C形成的化合物为NaF,属于离子化合物,电子式为
;B和C形成的化合物为NaF,属于离子化合物,电子式为![]() ;(2)电子层结构相同的离子,核电荷数越大离子半径越小,故简单离子的半径大小为r(F-)>r(Al3+);(3)①单质的颜色属于物理性质,不能比较元素非金属性强弱,①错误;②非金属性与氢化物稳定性一致,②正确;C.同主族自上而下非金属性减弱,③正确;D.同主族原子半径越小,对电子吸引越强,非金属性越强,④正确;E.F元素没有含氧酸,⑤错误,答案选①⑤;(4)氯元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1∶3,相对分子质量为120.5,则另一种元素的相对原子质量是
;(2)电子层结构相同的离子,核电荷数越大离子半径越小,故简单离子的半径大小为r(F-)>r(Al3+);(3)①单质的颜色属于物理性质,不能比较元素非金属性强弱,①错误;②非金属性与氢化物稳定性一致,②正确;C.同主族自上而下非金属性减弱,③正确;D.同主族原子半径越小,对电子吸引越强,非金属性越强,④正确;E.F元素没有含氧酸,⑤错误,答案选①⑤;(4)氯元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1∶3,相对分子质量为120.5,则另一种元素的相对原子质量是![]() ,即该元素是N,所以该物质的结构式为
,即该元素是N,所以该物质的结构式为![]() 。(5)①单质钠熔化成闪亮的小球,说明该反应是放热反应,①正确;②生成H2中含有水蒸汽,液态水变成气态水是吸热过程,属于物理变化,不是吸热反应,②错误;③该反应是氧化还原反应,但并不是所有氧化还原反应都是放热反应,例如碳与二氧化碳反应是吸热反应,③错误,答案选①。
。(5)①单质钠熔化成闪亮的小球,说明该反应是放热反应,①正确;②生成H2中含有水蒸汽,液态水变成气态水是吸热过程,属于物理变化,不是吸热反应,②错误;③该反应是氧化还原反应,但并不是所有氧化还原反应都是放热反应,例如碳与二氧化碳反应是吸热反应,③错误,答案选①。


科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是()
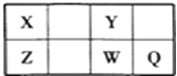
A. 钠与W可能形成Na2W2化合物
B. 由Z与Y组成的物质在熔融时能导电
C. W得电子能力比Q强
D. X有多种同素异形体,而Y不存在同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
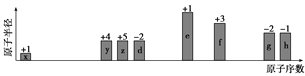
根据判断出的元素及相应化学式回答问题:
(1)f在周期表中的位置是________________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):____________;比较g、h的最高价氧化物对应水化物的酸性强弱:______________。
(3)y形成的最简单气态氢化物的空间构型__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是短周期元素形成的四种气体单质.E、F均为气体,且F为红棕色.有关的转化关系如图所示(反应条件均已略去).请回答下列问题: 
(1)B的电子式为 , E的化学式为 .
(2)写出实验室制备Y化学反应方程式为 .
(3)Y和F在一定条件下可反应生成两种无毒无污染的物质,这是一个具有实际意义的反应,可消除F对环境的污染,该反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学设计实验探究Fe3+与Fe2+相互转化,实验方案及现象如下: Ⅰ.配制FeCl2溶液
取部分变质的氯化亚铁固体[含有难溶性杂质Fe(OH)2Cl],向其中加入稀盐酸,使其完全溶解,再加入适量铁粉.
Ⅱ.实验探究Fe3+与Fe2+相互转化
实验1:0.1mol/L FeCl2溶液 ![]() 无明显现象
无明显现象 ![]() 溶液变红
溶液变红
实验2:0.1mol/L FeCl3溶液 ![]() 溶液变红
溶液变红 ![]() 溶液红色未褪去
溶液红色未褪去
(1)写出Fe(OH)2Cl与盐酸反应的离子方程式 .
(2)请用离子方程式解释实验1中滴加氯水后溶液变红的原因 .
(3)实验2的现象与预测不同,为探究可能的原因,该小组同学又进行了如下实验,方案及现象如下: 步骤1:10mL 0.1mol/L KI溶液 ![]() 溶液明显变黄
溶液明显变黄
步骤2:将黄色溶液分为三份:
试管1 取2mL黄色溶液 ![]() 溶液变红
溶液变红
试管2 取3mL黄色溶液 ![]() 溶液变蓝
溶液变蓝
试管3 取3mL黄色溶液 ![]() 取上层溶液
取上层溶液 ![]() 溶液变蓝(比试管2中溶液颜色深)
溶液变蓝(比试管2中溶液颜色深)
①试管2中滴加K3[Fe(CN)6]检验的离子是 .
②黄色溶液中含有的溶质微粒有K+、Cl﹣ 和 .
③综合上述实验现象,得出的实验结论是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见反应的化学方程式是A+B→X+Y+H2O(未配平,反应条件略去),其中A、B的物质的量之比为了1:4.请回答:
(1)若Y是黄绿色气体,则Y的电子式是 , 该反应的离子方程式是 .
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是 .
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中. ①A元素在周期表中的位置是(填所在周期和族);Y的化学式是 .
②含amol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是
mol.
(4)若A、B、X、Y均为化合物.向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色.则A与B按物质的量之比1:4恰好反应后,溶液中离子浓度从大到小的顺序是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化合物,单质,混合物,电解质和非电解质的正确组合是( )
化合物 | 单质 | 混合物 | 电解质 | 非电解质 | |
A | 烧碱 | 液态氧 | 冰水混合物 | 醋酸 | 三氧化硫 |
B | 生石灰 | 白磷 | 胆矾 | 氧化铝 | 氯气 |
C | 干冰 | 铁 | 氨水 | 石灰石 | 酒精 |
D | 空气 | 氮气 | 小苏打 | 氯化铜 | 硫酸钡 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com