
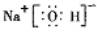 .
.
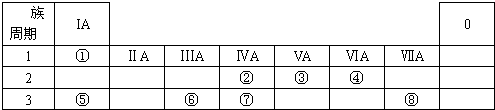
分析 由元素在周期表中的位置,可知①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl,
(1)电子层越多半径越大,电子层一样多的原子,核电荷数越多半径越小;
(2)非金属性越强,对应最高价氧化物对应水化物的酸性逐渐增强;
(3)①、④、⑤可形成既含离子键又含极性共价键的化合物为NaOH;
(4)M是仅含非金属的盐所以一定是铵盐;Z$\stackrel{△}{→}$N→⑥的单质.根据周期表的结构判断⑥是金属铝,所以推断N是氧化铝,Z是氢氧化铝,结合反应:X+Y+H2O→Al(OH)3+NH4+ 可知,X与Y的反应为铝盐和一水合氨的反应.
解答 解:由元素在周期表中的位置,可知①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl,
(1)电子层越多半径越大,所以Na、Al>O,电子层一样多的原子,核电荷数越多半径越小,即Na>Al,
故答案为:Na>Al>O;
(2)②③是C、N,是同一周期元素的原子,根据元素周期律:从左到右最高价氧化物对应水化物的酸性逐渐增强,所以酸性:HNO3>H2CO3,⑧为Cl,对应最高价氧化物对应水化物为HClO4,为所有含氧酸中酸性最强的酸,
故答案为:HClO4;
(3)①、④、⑤可形成既含离子键又含极性共价键的化合物为NaOH,其电子式为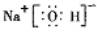 ,故答案为:
,故答案为: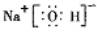 ;
;
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生如图转化的反应,其中M是仅含非金属的盐,所以一定是铵盐;Z$\stackrel{△}{→}$N→⑥的单质;根据周期表的结构判断⑥是金属铝,可知N是氧化铝电解生成金属铝,Z是氢氧化铝受热分解生成氧化铝,结合反应:X+Y+H2O→Al(OH)3+NH4+、Y能使湿润的红色石蕊试纸变蓝可知,X为AlCl3,Y为一水合氨,所以X溶液与Y溶液反应的离子方程式为Al3++3NH3+3H2O=Al(OH)3↓+3NH4+,
故答案为:AlCl3;A13++3NH3•H2O=A1(OH) 3↓+3NH4+.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、元素化合物知识等为解答的关键,侧重分析与应用能力的考查,注意周期表的结构及规律性知识的应用,题目难度不大.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3CH(CH2Br)2 | B. | CH3CH2CHBrCH2Br | C. | CH3CHBrCHBrCH3 | D. | (CH3)2CBrCH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
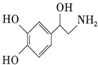
| A. | 每个去甲肾上腺素分子中含有3个酚羟基 | |
| B. | 去甲肾上腺素属于氨基酸 | |
| C. | 1mol去甲肾上腺素最多能与2molBr2发生取代反应 | |
| D. | 去甲肾上腺素既能与盐酸反应,又能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
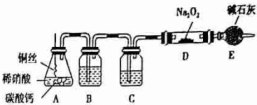
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数和核外电子数 | B. | 质量数和最外层电子数 | ||
| C. | 电子层数和最外层电子数 | D. | 电子层数和中子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电负性:He>F>O | B. | 第一电离能:O>N>P | ||
| C. | 离子半径:S2->Cl->Ca2+ | D. | 热稳定性:H2O>H2Se>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) | |
| B. | 我们所吃的豆腐中主要含有葡萄糖 | |
| C. | 棉花和蚕丝的主要成分都是纤维素 | |
| D. | 奶制品的非法添加物三聚氰胺(市场上称“蛋白精”)是一种有毒蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com