
分析 用化学式和离子符号表示电离过程的式子,称为电离方程式.离子所带电荷数一般可根据它们在化合物中的化合价来判断.所有阳离子带的正电荷总数与所有阴离子所带的负电荷总数相等,强电解质在溶液中能完全电离用“=”,弱电解质部分电离用“?”,多元弱酸,应分步电离,离子团在电离方程式中不能拆开,据此进行分析解答.
解答 解:A.硫酸是强电解质,一步电离出氢离子和硫酸根离子,即H2SO4═2H++SO42-,
故答案为:H2SO4═2H++SO42-;
B.氢氧化钡是强碱,完全电离出钡离子和氢氧根离子,即Ba(OH)2=Ba2++2OH-;
故答案为:Ba(OH)2=Ba2++2OH-;
C.硫酸铜是强电解质,电离时电离出自由移动的铜离子和硫酸根离子,CuSO4=Cu2++SO42-;
故答案为:CuSO4=Cu2++SO42-;
D.硝酸铵为强电解质,在水中电离出氨根离子和硝酸根离子,电离方程式:NH4NO3=NH4++NO3-;
故答案为:NH4NO3=NH4++NO3-;
E.NaHSO4是强电解质,NaHSO4在水中电离出钠离子和硫酸根离子和氢离子,NaHSO4═Na++H++SO42-;
故答案为:NaHSO4═Na++H++SO42-.
点评 本题考查电离方程式的书写知识,注意强电解质在溶液中能完全电离,弱电解质部分电离,离子团在电离方程式中不能拆开,强酸的酸式根离子要拆开,弱酸的酸式根离子不能拆开,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 2 或 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给反应体系适当加热 | B. | 向反应体系中加水稀释 | ||
| C. | 加入少量氧化铜固体 | D. | 加入催化剂或加压 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某兴趣小组设计了如图所示的原电池,请结合图中信息回答下列问题:
某兴趣小组设计了如图所示的原电池,请结合图中信息回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,1.01×105Pa,11.2L Cl2含有的分子数小于0.5NA | |
| B. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为1NA | |
| C. | 1molFeCl3与沸水反应生成NA个Fe(OH)3胶粒 | |
| D. | 常温下,23 g NO2含有2NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(B2)=0.8mol/(L•s) | B. | v(A2)=0.4mol/(L•s) | C. | v(C)=0.6mol/(L•s) | D. | v(B2)=1.0mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4=H2++SO42- | B. | Ba(OH)2=Ba2++OH - | ||
| C. | NaNO3=Na ++NO3- | D. | CuSO4=Cu+2+SO4-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
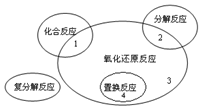 (1)氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是D
(1)氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是D查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com