
【题目】下列图示与对应的叙述相符的是
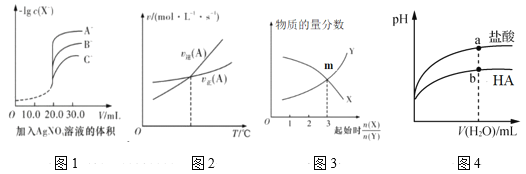
A.用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均与Ag+反应生成沉淀),由图1可确定首先沉淀的是C-
B.图2表示反应中某反应物的正、逆反应速率随温度变化的情况, 由图可知该反应的正反应是吸热反应
C.图3表示一定条件下,X(g)![]() Y(g)+Z(s)中物质的量分数随起始投料比变化。m点对应的X转化率为33.3%
Y(g)+Z(s)中物质的量分数随起始投料比变化。m点对应的X转化率为33.3%
D.图4表示常温下稀释pH相同的HA与盐酸时溶液pH与加入水体积的关系,则HA为弱酸,且a点Kw的数值比b点的大
【答案】C
【解析】
A. 用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均与Ag+反应生成沉淀),由图1可确定A-的浓度最小,则首先沉淀的是A-,A选项错误。
B. 图2表示反应中某反应物的正、逆反应速率随温度变化的情况,由图可知温度升高,最终A的逆反应速率大,说明平衡逆向移动,从而说明该反应的正反应是放热反应,B选项错误。
C. 图3表示一定条件下,X(g)![]() Y(g)+Z(s)中物质的量分数随起始投料比变化。设m点时X的变化量为a,
Y(g)+Z(s)中物质的量分数随起始投料比变化。设m点时X的变化量为a,
X(g)![]() Y(g)+Z(s)
Y(g)+Z(s)
起始量 3 1
变化量 a a
平衡量 3-a 1+a
则有3-a=1+a a=1
对应的X转化率为![]() =33.3%,C正确。
=33.3%,C正确。
D. 图4表示常温下稀释pH相同的HA与盐酸时溶液pH与加入水体积的关系,则HA为弱酸;但a点Kw的数值与b点的相同,因为温度不变,KW不变。D选项错误。
故选C。


科目:高中化学 来源: 题型:
【题目】常温下0.1molL﹣1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是
A. 将溶液稀释到原体积的2倍B. 加入适量的醋酸钠固体
C. 加入等体积0.2 molL﹣1盐酸D. 加少量冰醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向20 mL浓度均为0.1 mol·L-1 NH4HSO4 、(NH4)2SO4混合溶液中逐滴加入0.1mol·L-1的Ba(OH)2溶液。充分反应后静置,Ba(OH)2溶液体积与溶液的pH的关系如下图,下列说法正确的是(假设过程中生成的NH3·H2O不分解)
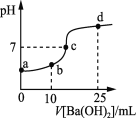
A.a点溶液中:c(NH4+)+c(NH3·H2O)=0.4 mol·L-1
B.b点溶液中:c(NH4+)>c(SO42-)>c(H+)>c(NH3·H2O)>c(OH-)
C.c点溶液中:c(Ba2+) + c(NH4+)=c(SO42-)
D.d点溶液中:c(NH3·H2O)>c(SO42-)>c(NH4+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.铅蓄电池在放电过程中,正极得到电子,电极质量增加
B.0.1mol/L CH3COOH溶液加水稀释后,溶液中![]() 减小
减小
C.SiO2(s)+2C(s)=Si(s)+2CO(g)必须在高温下反应才能发生,则ΔH>0
D.合成氨生产中将NH3液化分离,可加快正反应速率,提高H2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年11月13日第26届国际计量大会对国际单位制进行修改。新的摩尔的定义规定,1摩尔物质包括阿伏加德罗常数NA个基本单元。下列有关阿伏加德罗常数NA的说法正确的是( )
A.常温常压下,11gCO2中含有0.75NA个原子
B.2.4g镁变成镁离子时,失去的电子数目为0.1NA
C.标准状况下,NA个水分子的体积约为22.4L
D.1L 0.3mol/L的NaCl溶液中含有0.3NA个NaCl分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是( )
A.可用水来确定某氧化钠粉末中是否含有过氧化钠
B.可用二氧化碳来确定某氧化钠粉末中是否含有过氧化钠
C.可利用在空气中加热的方法除去氧化钠中的过氧化钠
D.将足量的过氧化钠、氧化钠分别加到酚酞溶液中,最终溶液均为红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列转化关系图,且知采用电解熔融氯化钠的方法可以生产金属钠:2NaCl(熔融)![]() 2Na+Cl2↑,下列说法不正确的是( )
2Na+Cl2↑,下列说法不正确的是( )

A.A、C、E一定含有同种元素B.若在B中点燃铜丝会产生棕黄色烟
C.C与D反应会产生红褐色沉淀D.D物质可能为FeCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在照相底片的定影过程中,未曝光的溴化银(AgBr)常用硫代硫酸钠(Na2S2O3)溶解,反应生成Na3[Ag(S2O3)2];在废定影液中加入Na2S使Na3[Ag(S2O3)2]中的银转化为Ag2S,并使定影液再生。将Ag2S在高温下转化为Ag,就达到了回收银的目的。
(1)铜、银、金在元素周期表中位于同一族相邻周期,基态铜原子的价电子排布式为___。
(2)Na、O、S简单离子半径由大到小的顺序为___。
(3)S2O32-离子结构如图所示,其中心硫原子的杂化轨道类型为___。
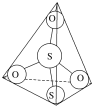
(4)Na3[Ag(S2O3)2]中存在的作用力有__。
A.离子键 B.共价键 C.范德华力 D.金属键 E.配位键
(5)在空气中灼烧Ag2S生成Ag和SO2,SO2分子中硫原子的价层电子对数为__,其分子空间构型为___。SO2易溶于水,原因是__。
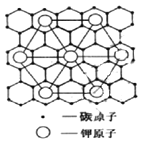
(6)SO2具有较强的还原性,碳与熔融金属钾作用,形成的晶体是已知最强的还原剂之一,碳的某种晶体为层状结构,钾原子填充在各层之间,形成间隙化合物,其常见结构的平面投影如图所示,则其化学式可表示为___。
(7)现在人们已经有多种方法来测定阿伏加德罗常数,X射线衍射法就是其中的一种,通过对金晶体的X 射线衍射图像的分析,可以得出金晶体的晶胞属于面心立方晶胞(与铜的晶胞相似)。若金原子的半径为am,金的密度为ρg·cm-3,金的摩尔质量为Mg·mol-1,试通过这些数据列出计算阿伏加德罗常数的算式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】8.8g FeS与400mL 1 mol/L硝酸溶液恰好完全反应,反应后产物为Fe2(SO4)3和Fe(NO3)3, X、H2O,则X为( )
A.N2B.NOC.N2OD.NO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com