

| A. | 图中反应Ⅰ、Ⅱ、Ⅲ均为氧化还原反应 | |
| B. | 图中反应Ⅰ、Ⅱ、Ⅲ均可在常温常压下进行 | |
| C. | 整个循环过程中产生1mol O2的同时产生44.8LH2 | |
| D. | 设计该循环是为了制取能源气体H2 |
分析 由图可知,反应I为二氧化硫与碘发生氧化还原反应生成硫酸和HI,该反应为SO2+2H2O+I2=H2SO4+2HI,反应Ⅲ是2HI$\frac{\underline{\;\;△\;\;}}{\;}$H2↑+I2↑,反应Ⅱ是硫酸分解为氧气的过程,据此回答.
解答 解:A、反应I为二氧化硫与碘发生氧化还原反应生成硫酸和HI,该反应为SO2+2H2O+I2=H2SO4+2HI,反应Ⅲ是2HI$\frac{\underline{\;\;△\;\;}}{\;}$H2↑+I2↑,反应Ⅱ是硫酸分解为氧气的过程,均为氧化还原反应,故A正确;
B、反应Ⅱ、Ⅲ不可在常温常压下进行,反应SO2+2H2O+I2=H2SO4+2HI可以在常温下进行,故B错误;
C、整个循环过程中产生1molO2的同时产生标况下44.8LH2,故C错误;
D、设计该循环是为了制取气体O2和H2,故D错误;
故选A.
点评 本题涉及物质的转化和氧化还原反应的有关知识,注意知识的归纳和梳理是解题的关键,难度中等.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 向0.10mol•L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-) | |
| B. | 0.10mol•L-1CH3COONa溶液中通入HCl:c(Na+)>c(Cl-)>c(CH3COOH) | |
| C. | 0.10mol•L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| D. | 向0.10mol•L-1NaHSO3溶液中通入NH3:c(Na+)>c(SO32-)>c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 对氯苯甲酸是一种药物中间体,可用对氯甲苯为原料,通过高锰酸钾氧化法制备.反应如下:
对氯苯甲酸是一种药物中间体,可用对氯甲苯为原料,通过高锰酸钾氧化法制备.反应如下: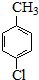 $→_{催化剂}^{KMnO_{4}}$
$→_{催化剂}^{KMnO_{4}}$
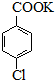 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$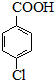
| 熔点/℃ | 沸点/℃ | 密度/g•cmˉ3 | 颜色 | 水溶性 | |
| 对氯甲苯 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
| 对氯苯甲酸 | 243 | 275 | 1.54 | 白色 | 微溶 |
| 对氯苯甲酸钾 | 具有盐的通性,属于可溶性盐,溶解度随温度升高而增大 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与水相比,AgCl在Na2CO3溶液中的溶解度及溶度积均增大 | |
| B. | 反应后的溶液中:c(Na+)>c(CO32-)>c(Cl-)=c(Ag+)>c(OH-)>c(H+) | |
| C. | 溶液中c(Cl-)=2×10-5mol•L-1 | |
| D. | 沉淀转化反应;2AgCl(s)+CO32-(aq)?Ag2CO3(s)+2Cl-(aq)的平衡常数为2×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸在水中电离:CH3COOH?H++CH3COO- | |
| B. | 乙烷和溴蒸气的混合物光照后发生反应:CH3CH3+Br2$\stackrel{光}{→}$CH3CH2Br+HBr | |
| C. | 苯在浓硫酸并加热条件下与浓硝酸发生反应: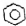 +HNO3$→_{50~60℃}^{浓硫酸}$ +HNO3$→_{50~60℃}^{浓硫酸}$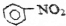 +H2O +H2O | |
| D. | 乙酸、乙醇和浓硫酸的混合物在加热条件下发生酯化反应:CH3COOH+CH3CH2OH$→_{△}^{催化剂}$CH3COOCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 次数 | 1 | 2 | 3 | 4 |
| 滴定体积(mL) | 19.22 | 19.18 | 19.80 | 19.20 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与氢气化合比溴与氢气化合容易 | |
| B. | 硒化氢比硫化氢稳定 | |
| C. | 氢氧化锶比氢氧化钙的碱性强 | |
| D. | 铍的原子失电子能力比镁弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com