
| A. | 将纯水加热至较高温度,水的离子积变大,pH减小,呈酸性 | |
| B. | 碱性氢氧燃料电池工作时,OH-向正极迁移 | |
| C. | 反应2A(g)+B(g)═3C(s)+D(g)在一定条件下能自发进行,说明该反应的△H>0 | |
| D. | 用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3 |
分析 A.水的电离是吸热反应,升高温度促进电离,溶液中c(H+)增大,但仍然存在c(H+)=c(OH-);
B.原电池放电时,电解质溶液中阴离子向负极移动;
C.化学反应中△G=△H-T△S<0时,该反应能自发进行;
D.如果Qc>Ksp时就能产生沉淀.
解答 解:A.水的电离是吸热反应,升高温度促进电离,溶液中c(H+)增大,pH减小,离子积常数增大,但仍然存在c(H+)=c(OH-),所以仍然呈中性,故A错误;
B.原电池放电时,电解质溶液中阴离子向负极移动,所以OH-向负极迁移,故B错误;
C.化学反应中△G=△H-T△S<0时,该反应能自发进行,应2A(g)+B(g)═3C(s)+D(g)在一定条件下能自发进行,说明该反应△G=△H-T△S<0,该反应的△S<0,则△H<0,故C错误;
D.BaSO4饱和溶液中加入饱和Na2CO3溶液有白色沉淀,是因为Qc>Ksp时而产生沉淀,所以用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3,故D正确;
故选D.
点评 本题考查水的电离、难溶物溶解平衡、反应焓变和熵变、原电池原理等知识点,侧重考查化学反应原理,注意不能根据溶液pH确定溶液酸碱性,要根据c(H+)、c(OH-)相对大小判断,易错选项是AD.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:填空题
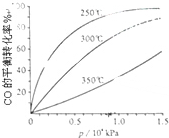 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
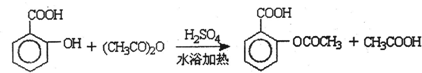
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充放电时,溶液中Pb2+浓度保持不变 | |
| B. | 放电时转移2mol电子,消耗2molPb | |
| C. | 放电时的负极反应式为:Pb-2e-═Pb2+ | |
| D. | 充电时的阳极反应式为:Pb2++4OH+2e-═PbO2+2HO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子数 | B. | 密度 | C. | 质子数 | D. | 质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ②③⑥ | C. | ①②④ | D. | ②③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com