
| A. | 第ⅠA族元素是同周期中金属性最强的金属元素 | |
| B. | 两个非金属原子间不可能形成离子键 | |
| C. | HF、HCl、HBr和HI的热稳定性和还原性依次减弱 | |
| D. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
分析 A.同周期自左而右,金属性减弱;
B.两个非金属原子间只能以共用电子对成键;
C.HF、HCl、HBr和HI还原性依次增强;
D.F没有最高正价.
解答 解:A.同周期自左而右,金属性减弱,故ⅠA族金属元素是同周期中金属性最强的金属元素,故A正确;
B.两个非金属原子间只能以共用电子对成键,则只能形成共价键,故B正确;
C.HF、HCl、HBr和HI的热稳定性依次减弱,还原性依次增强,故C错误;
D.根据主族元素最高正化合价与族序数的关系,推出卤族元素除F元素外,最高正价都是+7,F没有最高正价,故D错误.
故选AB.
点评 本题考查了碱金属、卤素、氢化物的稳定性、同主族元素性质的变化规律,题目难度不大,注意把握元素周期律及其应用.


科目:高中化学 来源: 题型:填空题
 碳是形成化合物最多的元素.
碳是形成化合物最多的元素. ?
? ++H+.
++H+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出 | |
| B. | 铝钠合金若投入一定的水中可得无色溶液,则n(Al)≤n(Na) | |
| C. | mg钠铝合金投入足量水中,若所得溶液只含一种溶质,则其中含有钠的质量为0.46mg | |
| D. | 若mg不同组成的铝钠合金投入足量盐酸中,若放出的H2越多,则钠的质量分数越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HOCH2CH2OH | B. | HOCH2CH(OH)CH3 | C. | HOCH2CH2CH2OH | D. | CH3CH(OH)CH(OH)CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量沉淀于试管中,加入足量0.1mol•L-1盐酸 | 沉淀全部溶解,有气泡产生,说明沉淀中有碳酸钙 |
| 步骤2:往步骤1的剩余物中,再滴加几滴0.01mol•L-1 KmnO4溶液 | 溶液紫红色褪去,说明沉淀中有CaC2O4,结合步骤1,假设2成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
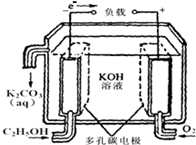 (1)广州是一座美丽的海滨城市,海水资源非常丰富.海洋电池是以铝为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流,电池总反应为:4Al+3O2+6H2O═4A1(OH)3,下列说法正确的是bc(填写序号字母);
(1)广州是一座美丽的海滨城市,海水资源非常丰富.海洋电池是以铝为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流,电池总反应为:4Al+3O2+6H2O═4A1(OH)3,下列说法正确的是bc(填写序号字母);查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com