
����Ŀ�����������ʵ���Һ��CH3COOH����HCl����H2SO4����NaHSO4
(1)��������Һ�����ʵ���Ũ����ͬ����c(H+)�Ĵ�С˳��Ϊ______(����ű�ʾ����ͬ)��
(2)��������Һ��c(H+)��ͬ�������ʵ���Ũ�ȵĴ�С˳��Ϊ________��
(3)��6 g CH3COOH����ˮ�Ƴ�1 L��Һ������Һ�����ʵ���Ũ��Ϊ________�����ⶨ��Һ��c(CH3COO-)Ϊ1.4��10��3 mol��L��1�����¶��´���ĵ��볣��Ka=________���¶����ߣ�Ka��______(�������������������������С������ͬ)����������CH3COONa��c(H��) _________��Ka________��ԭ����_____________��
���𰸡���>��=��>�� ��>��=��>�� 0.1mol/L 1.96��10-5 ��� ��С ���� Kwֻ���¶��йأ��¶Ȳ��䣬Kw����
��������
(1)������һԪ���ᡢ������һԪǿ�ᡢ�����Ƕ�Ԫǿ�ᡢ���������൱��һԪǿ�
(2)������һԪ���ᡢ������һԪǿ�ᡢ�����Ƕ�Ԫǿ�ᡢ���������൱��һԪǿ�ᣬ�ݴ˷�����
(3)�ȸ���n=![]() ����CH3COOH�����ʵ�����Ȼ�����c=
����CH3COOH�����ʵ�����Ȼ�����c=![]() �������ʵ���Ũ�ȣ�����k=
�������ʵ���Ũ�ȣ�����k=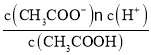 �������С���ж����µ���ƽ�ⳣ���ı仯��������������������ʵĵ���ƽ���Ӱ���ж�����Ũ�ȵı仯������ƽ�ⳣ��ֻ���¶�Ӱ��.
�������С���ж����µ���ƽ�ⳣ���ı仯��������������������ʵĵ���ƽ���Ӱ���ж�����Ũ�ȵı仯������ƽ�ⳣ��ֻ���¶�Ӱ��.
(1)������һԪ���ᡢ������һԪǿ�ᡢ�����Ƕ�Ԫǿ�ᡢ���������൱��һԪǿ�ᣬ����CH3COOH����HCl����H2SO4����NaHSO4��Һ�����ʵ���Ũ����ͬ����c(H+)�Ĵ�С˳��Ϊ����>��=��>�٣�
(2)������һԪ���ᡢ������һԪǿ�ᡢ�����Ƕ�Ԫǿ�ᡢ���������൱��һԪǿ�ᣬ����CH3COOH����HCl����H2SO4����NaHSO4��Һ��c(H+)��ͬ���������ʵ���Ũ�ȴ�С˳��Ϊ����>��=��>�ۣ�
(3)n(CH3COOH)=![]() =0.1mol���������Һ�����ʵ���Ũ��c(CH3COOH)=
=0.1mol���������Һ�����ʵ���Ũ��c(CH3COOH)=![]() =0.1mol/L�����ݴ���ĵ���ƽ�⣺CH3COOH
=0.1mol/L�����ݴ���ĵ���ƽ�⣺CH3COOH![]() CH3COO-+H+��֪����Һ��c(H+)=c(CH3COO-)=1.4��10-3mol/L�������������ʵĵ���ƽ�ⳣ�������֪K=
CH3COO-+H+��֪����Һ��c(H+)=c(CH3COO-)=1.4��10-3mol/L�������������ʵĵ���ƽ�ⳣ�������֪K=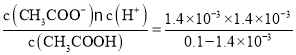 =1.96��10-5��
=1.96��10-5��
�������������������������¶ȴٽ�����ĵ��룬ʹ����ƽ�ⳣ�������������Һ�м�������ƣ����������Ũ��������ĵ���ƽ�������ƶ�����Һ��������Ũ�ȼ�С�����ڵ���ƽ�ⳣ��ֻ���¶��йأ��¶Ȳ��䣬����ĵ���ƽ�����Ͳ��䡣


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���ͬŨ�ȵ�����һԪ��HX��HY�ֱ���ͬһŨ�ȵ�NaOH����Һ�ζ����ζ�������ͼ��ʾ������˵����ȷ����![]()
![]()
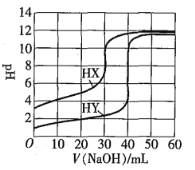
A.HX��HY��ʼ��Һ�����ͬ
B.�����ü������ζ�ָʾ��
C.pH��ͬ����������Һ�У�![]()
D.ͬŨ��KX��HX�Ļ����Һ�У�����Ũ�ȼ���ڹ�ϵʽ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ֱ��ʾ�йط�Ӧ�ķ�Ӧ�����������仯�Ĺ�ϵ�������ж���ȷ����( )
A. 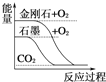 ʯīת��ɽ��ʯ�����ȷ�Ӧ
ʯīת��ɽ��ʯ�����ȷ�Ӧ
B. 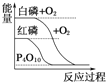 ���ױȺ����ȶ�
���ױȺ����ȶ�
C. 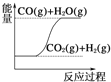 CO(g)+H2O(g)��CO2(g)+H2(g) ��H��0
CO(g)+H2O(g)��CO2(g)+H2(g) ��H��0
D. 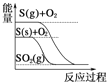 S(g)+O2(g)��SO2(g) ��H1 S(s)+O2(g)��SO2(g) ��H2,����H1����H2
S(g)+O2(g)��SO2(g) ��H1 S(s)+O2(g)��SO2(g) ��H2,����H1����H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У���ӦxA(g)+yB(g)![]() zC(g)��ƽ��ʱ��A��Ũ��Ϊ0.5mol/L���������¶Ȳ��䣬���������ݻ�����ԭ����2��������ƽ��ʱA��Ũ�Ƚ�Ϊ0.3mol/L�������ж���ȷ���ǣ� ��
zC(g)��ƽ��ʱ��A��Ũ��Ϊ0.5mol/L���������¶Ȳ��䣬���������ݻ�����ԭ����2��������ƽ��ʱA��Ũ�Ƚ�Ϊ0.3mol/L�������ж���ȷ���ǣ� ��
A.x��y<zB.ƽ��������Ӧ�����ƶ�
C.B��ת���ʽ���D.C�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���3 mol A��1 mol B�����������ڹ̶��ݻ�Ϊ2 L���ܱ������У��������·�Ӧ��3A(g)��B(g) ![]() xC(g)��2D(g)��2 minĩ�÷�Ӧ�ﵽƽ�⣬����0.8 mol D�������C��Ũ��Ϊ0.8 mol��L��1�������жϴ�����ǣ�������
xC(g)��2D(g)��2 minĩ�÷�Ӧ�ﵽƽ�⣬����0.8 mol D�������C��Ũ��Ϊ0.8 mol��L��1�������жϴ�����ǣ�������
A. x��4 B. 2 min��B�ķ�Ӧ����Ϊ0.1 mol��(L��min)��1
C. ��������ܶȲ��䣬������÷�Ӧ�Ѵﵽƽ��״̬ D. B��ת����Ϊ40%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������Ԥ���װ�õ�ѡ����ȷ���� �� ��
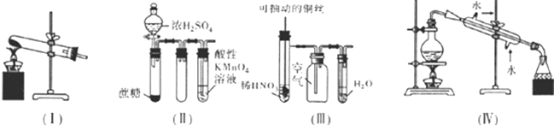
A.��װ�ã����Ȳ��ᾧ��ķ�����ȡijЩ���壨���ᾧ����۵�101.5�棬�ֽ��¶�ԼΪ150�棩
B.��װ�ã�����ʵ��ʱ������KMnO4��Һ�г������ݣ�����ɫ����ȥ
C.��װ�ã�����ʵ��ʱ�����ƿ������dz����ɫ������ֺ��ֱ�Ϊ��ɫ���Ҳ����������Ⱦ
D.��װ�ã����������屽�ͱ��Ļ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС��ͨ���������ϣ��������ͼ��ʾ�ķ����Ժ����ϴ���Ϊԭ�����Ʊ�NiSO4��7H2O����֪ij�������ĺ����ϴ�����Ҫ����Ni��������Al��31%����Fe��1.3%���ĵ��ʼ�����������������ʣ�3.3%��

����������������������ʽ����ʱ��pH�����
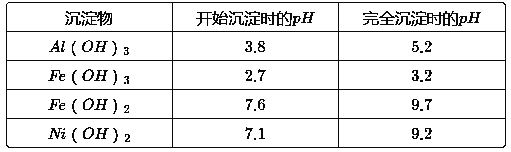
��1����Һ���е���������_________���������ʱ�����������____________���ѧʽ����
��2������H2O2ʱ������Ӧ�����ӷ���ʽΪ________________________������bΪ������Һ��pH������ΪpH�ĵ��ط�Χ��___________________��
��3����Ʒ�����л��������̷���FeSO4��7H2O������ԭ�������_______________��д��һ�㼴�ɣ���
��ȡ50�˸ò�Ʒ�������100mL��Һ��ȡ20mL����Һ��0.1mol/L������KMnO4��Һ�ζ�����������KMnO4��Һ10mL��Ni2+��������������ò�Ʒ����Ĵ�����___________��
��4��NiSO4��7H2O�������Ʊ������أ�NiMH����NiMH�е�M��ʾ���������Ͻ𡣸õ���ڳ��������ܷ�Ӧ�Ļ�ѧ����ʽ��Ni(OH)2+M=NiOOH+MH����NiMH��طŵ�����������缫��Ӧʽ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵���������
A.1molCl2�����Fe�۷�Ӧ����FeCl3��ת��2NA������
B.���³�ѹ�£�0.1mol���к���˫������ĿΪ0.3NA
C.1molZn��һ����Ũ����ǡ����ȫ��Ӧ�������ɵ����������ΪNA
D.�ڷ�ӦKClO4��8HCl=KCl��4Cl2����4H2O�У�ÿ����1molCl2ת�Ƶĵ�����Ϊ1.75NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����25��ʱ������ʵ���ƽ������Ka��CH3COOH��=1.8��10-5��Ka��HSCN��=0.13�����ܵ���ʵ��ܶȻ�������Ksp��CaF2��=1.5��10-10
��25��ʱ��2.0��10-3mol/L�����ˮ��Һ�У�������ҺpH����������仯�����õ�c��HF����c��F-������ҺpH�ı仯��ϵ����ͼ1��ʾ��


��1�������й�����������п���֤������������ʵ���________________
A. ������0.1mol/L���������ҺpHԼΪ2
B. �������Һ��ʹ��ɫʯ����Һ���
C. 10mL 1mol/L �����ǡ����10mL 1mol/L NaOH��Һ��ȫ��Ӧ
D. ij�������Һ�����þ��Ӧ�����ʱȽ���
E. ��ͬ�������������Һ�ĵ����������������
��2��NaF��һ��ũҵɱ�������Һ����������Ũ�ȴ�С��ϵΪ___________________
��3��25��ʱ����20mL 0.10 mol/L CH3COOH��Һ��20mL 0.10 mol/LHSCN��Һ�ֱ���20mL 0.10 mol/LNaHCO3��Һ��ϣ��ֱ�õ���Һ1����Һ2��ʵ�����������������V����ʱ�䣨t���仯��ͼ2��ʾ������a��ӳ����________________������CH3COOH������HSCN������NaHCO3��ӳ��������ı仯�������Ӧ��������������Һ�У�c(OH-)��Һ1_______c(OH-)��Һ2 ����������������������=����
��4��CaF2����өʯ��������ˮ������4.0��10-3mol/L HF��Һ��2.0��10-4mol/L CaCl2��Һ�������ϣ����ڻ��ҺpHΪ4.0�����Ե��ڻ��Һ����ı仯�����жϴ�ʱ��Һ���Ƿ���CaF2�������ɲ�˵������______
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com