
| A. | 可用铝制容器盛装稀硫酸 | B. | Na2O2可用作供氧剂 | ||
| C. | Fe2O3常用于制造红色油漆和涂料 | D. | Si可用于制造太阳能电池 |
分析 A.铝是较活泼的金属能和稀硫酸反应生成氢气和硫酸铝;
B.过氧化钠能和二氧化碳、水反应生成氧气;
C.氧化铁是红棕色固体,常用于制造红色油漆和涂料;
D.硅是半导体,可以制成硅电池.
解答 解:A.常温下,铝能和稀硫酸生成氢气和硫酸铝,但和浓硫酸反应生成一层致密的氧化物薄膜阻止进一步反应而发生钝化现象,所以可用铝制容器盛装浓硫酸,故A错误;
B.过氧化钠和二氧化碳、水反应生成氧气,所以过氧化钠可用于呼吸面具中作为氧气的来源,故B正确;
C.氧化铁是红棕色固体,俗称铁红,常用于制造红色油漆和涂料,故C正确;
D.硅的导电性介于导体和绝缘体之间,是良好的半导体材料,利用高纯硅的半导体性能,可用制造太阳能电池,故D正确;
故选A.
点评 本题考查了元素化合物的性质,注意常温下,浓硫酸、浓硝酸能和铝、铁发生钝化现象,但稀硫酸和稀硝酸不能和铝、铁发生钝化现象.


科目:高中化学 来源: 题型:选择题
 八角茴香含有一种抗亚洲禽流感病毒的重要成分-莽草酸,其分子结构如图所示.下列关于莽草酸的说法错误的是( )
八角茴香含有一种抗亚洲禽流感病毒的重要成分-莽草酸,其分子结构如图所示.下列关于莽草酸的说法错误的是( )| A. | 能溶于水 | B. | 能使酸性高锰酸钾溶液褪色 | ||
| C. | 能发生酯化反应 | D. | 遇FeCl3溶液呈紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+H-OH$\frac{\underline{催化剂}}{△}$CH3-CH2-OH | |
| B. | CH2=CH-CH=CH2+2H2$\frac{\underline{\;催化剂\;}}{\;}$CH3-CH2-CH2-CH3 | |
| C. |  +H2$\stackrel{催化剂}{→}$CH3-CH2-OH +H2$\stackrel{催化剂}{→}$CH3-CH2-OH | |
| D. | CH3-CH3+2Cl2$\stackrel{光照}{→}$CH2Cl-CH2Cl+2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常溫下,向100mL 0.0lmol/L HA的溶液中逐滴加入0.02mo1/L MOH 溶液,如图所示,曲线表示流合溶液的pH变化情况(溶液体积 变化忽略不计),下列说法中正确的是( )
常溫下,向100mL 0.0lmol/L HA的溶液中逐滴加入0.02mo1/L MOH 溶液,如图所示,曲线表示流合溶液的pH变化情况(溶液体积 变化忽略不计),下列说法中正确的是( )| A. | HA为一元强酸,NOH为一元强碱 | |
| B. | N点水的电离程度小于K点水的电离程度 | |
| C. | K点所示溶液中c(A-)>c(M+) | |
| D. | K点对应的溶液中,有c(MOH)+c(M+)=0.01mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,预测该芳香烃能(填“能”或“不能”)发生该类反应.
,预测该芳香烃能(填“能”或“不能”)发生该类反应.
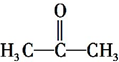
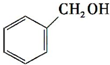 c.
c.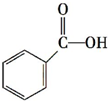
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若 Vl>V2,则说明HA的酸性比 HB的酸性强 | |
| B. | 中和后得到的两种溶液的pH均为 7 | |
| C. | 分别将两种酸溶液稀释10 倍后溶液的pH均为3 | |
| D. | 分别往等体积的两种酸溶液中加人足量锌粉,充分反应后产生的H2的体积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
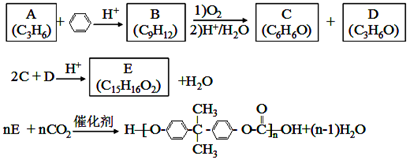
 ;D有多种同分异构体,其中含有醛基的是CH3CH2CHO.按官能团分类E为酚.
;D有多种同分异构体,其中含有醛基的是CH3CH2CHO.按官能团分类E为酚.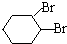 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$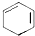 +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com