
【题目】合成氨工业涉及固体燃料的气化,需要研究CO2与CO之间的转化。为了弄清其规律,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g) ![]() 2CO(g) H,测得压强、温度对CO、CO2的平衡组成的影响如图所示,回答下列问题:
2CO(g) H,测得压强、温度对CO、CO2的平衡组成的影响如图所示,回答下列问题:

(1)p1、p2、p3的大小关系是________,图中a、b、c三点对应的平衡常数大小关系是______________________。
(2)一定条件下,在CO2与足量碳反应所得平衡体系中加入H2和适当催化剂,有下列反应发生:反应1:CO(g)+3H2(g) ![]() CH4(g)+H2O(g) H1= a kJ/mol
CH4(g)+H2O(g) H1= a kJ/mol
反应2:CO(g)+H2O(g) ![]() CO2(g)+H2(g) H2= b kJ/mol
CO2(g)+H2(g) H2= b kJ/mol
① 则二氧化碳与氢气反应转化为甲烷和水蒸气的热化学方程式是____________。
② 已知298 K时相关化学键键能数据为:
化学键 | H—H | O—H | C—H |
|
E/(kJ·mol-1) | 436 | 465 | 413 | 1076 |
则根据键能计算,H1=________________。反应1自发进行的条件是___________。(填“较高温度”、“较低温度”、“任意温度”)
(3)一定条件下,CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH3,向固定容积为1 L的密闭容器中充入2 mol CO2和6 mol H2,一段时间后达到平衡状态,测得CH3OH(g)的物质的量为1mol,则此条件下该反应的化学平衡常数K =_________(用分数表示);若开始时充入2 mol CH3OH(g) 和2 mol H2O(g)达到相同平衡状态时,CH3OH的转化率为_______;若平衡后再充入4 mol的N2,则c(CO2)和原平衡比较是_________。(填“增大”、“减小”、“不变”)
CH3OH(g)+H2O(g) ΔH3,向固定容积为1 L的密闭容器中充入2 mol CO2和6 mol H2,一段时间后达到平衡状态,测得CH3OH(g)的物质的量为1mol,则此条件下该反应的化学平衡常数K =_________(用分数表示);若开始时充入2 mol CH3OH(g) 和2 mol H2O(g)达到相同平衡状态时,CH3OH的转化率为_______;若平衡后再充入4 mol的N2,则c(CO2)和原平衡比较是_________。(填“增大”、“减小”、“不变”)
(4)如图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。

①甲中负极的电极反式为_______________,丙中C极的电极反应式为___________。
② 乙中A极析出的气体在标准状况下的体积为__________________。
【答案】p1<p2<p3 Ka=Kb<Kc CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) H=(a-b) kJ·mol-1 -198 kJ·mol-1 较低温度
CH4(g)+2H2O(g) H=(a-b) kJ·mol-1 -198 kJ·mol-1 较低温度 ![]() 50% 不变 CH3OH-6e- +8OH- = CO32-↑+6H2O Cu-2e-=Cu2+ 2.24L
50% 不变 CH3OH-6e- +8OH- = CO32-↑+6H2O Cu-2e-=Cu2+ 2.24L
【解析】
(1)根据压强对平衡移动的影响分析压强的大小关系;平衡常数只与温度有关,温度不变,平衡常数不变,再结合图像分析温度对平衡移动的影响,从而分析平衡常数的大小关系;
(2)①根据已知热化学方程式,并结合盖斯定律可得目标热化学方程式;
②H1=反应物断键吸收的能量-生成物成键放出的能量;先反应1的H<0,S<0,若H-TS<0,反应1能自发进行,从而判断应为低温条件反应可自发进行;
(3)根据已知信息列出三段式计算平衡常数;若开始时充入2 mol CH3OH(g) 和2 mol H2O(g)达到相同平衡状态,则平衡时CH3OH的物质的量为1mol,从而计算甲醇的转化率;容器容积固定不变,充入无关气体,反应体系中各物质的浓度不变,平衡不移动;
(4)甲醇燃料电池为原电池,通入甲醇的一极为负极,通入氧气的一极为正极,乙、丙为电解池,乙中A为阳极,B为阴极,C为阳极,D为阴极,
①甲醇燃料电池为原电池,甲醇在负极发生氧化反应;丙中C极为阳极,C为铜电极,则铜在阳极失电子发生氧化反应;
②乙中为惰性电极电解100mL 1mol/LCuSO4溶液,已知A、B两极上产生的气体体积相同,由分析可知,乙中A为阳极,产物为氧气,B为阴极,铜离子先放电,然后氢离子放电得氢气,设生成气体物质的量为x,再根据阴阳两极转移电子数相同进行计算。
(1)对于反应C(s)+CO2(g) ![]() 2CO(g),温度一定时,增大压强平衡逆向移动,CO的百分含量减小,则p1<p2<p3;平衡常数只与温度有关,温度不变,平衡常数不变,则Ka=Kb,由图像可知,升高温度,平衡正向移动,则Kb<Kc;
2CO(g),温度一定时,增大压强平衡逆向移动,CO的百分含量减小,则p1<p2<p3;平衡常数只与温度有关,温度不变,平衡常数不变,则Ka=Kb,由图像可知,升高温度,平衡正向移动,则Kb<Kc;
故答案为:p1<p2<p3;Ka=Kb<Kc;
(2)① 根据已知热化学方程式:反应1:CO(g)+3H2(g) ![]() CH4(g)+H2O(g) H1= a kJ/mol;反应2:CO(g)+H2O(g)
CH4(g)+H2O(g) H1= a kJ/mol;反应2:CO(g)+H2O(g) ![]() CO2(g)+H2(g) H2= b kJ/mol;结合盖斯定律可得,反应1-反应2可得目标方程式CO2(g)+4H2(g)
CO2(g)+H2(g) H2= b kJ/mol;结合盖斯定律可得,反应1-反应2可得目标方程式CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) H=(a-b) kJ·mol-1;
CH4(g)+2H2O(g) H=(a-b) kJ·mol-1;
故答案为:CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) H=(a-b) kJ·mol-1;
CH4(g)+2H2O(g) H=(a-b) kJ·mol-1;
②H1=反应物断键吸收的能量-生成物成键放出的能量=(1076+3×436-4×413-2×465)kJ·mol-1=-198 kJ·mol-1;反应1的H<0,S<0,若H-TS<0,反应1能自发进行,则应为低温条件;
故答案为:-198 kJ·mol-1;较低温度;
(3)根据已知信息,可列出三段式:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
开始(mol/L) 2 6 0 0
变化(mol/L) 1 3 1 1
平衡(mol/L) 1 3 1 1
则平衡常数为![]() ;
;
若开始时充入2 mol CH3OH(g) 和2 mol H2O(g)达到相同平衡状态,则平衡时CH3OH的物质的量为1mol,则CH3OH的转化率为![]() ;
;
容器容积固定不变,则平衡后再充入4 mol的N2,反应体系中各物质的浓度不变,则平衡不移动,则c(CO2)和原平衡比较不变;
故答案为:![]() ;50%;不变;
;50%;不变;
(4)甲醇燃料电池为原电池,通入甲醇的一极为负极,通入氧气的一极为正极,乙、丙为电解池,乙中A为阳极,B为阴极,C为阳极,D为阴极,
①甲醇燃料电池为原电池,甲醇在负极发生氧化反应,电极反应式为CH3OH-6e- +8OH- = CO32-↑+6H2O;丙中C极为阳极,C为铜电极,则铜在阳极失电子发生氧化反应,则电极反应式为Cu-2e-=Cu2+;
故答案为:CH3OH-6e- +8OH- = CO32-↑+6H2O;Cu-2e-=Cu2+;
②乙中为惰性电极电解100mL 1mol/LCuSO4溶液,已知A、B两极上产生的气体体积相同,由分析可知,乙中A为阳极,产物为氧气,B为阴极,铜离子先放电,然后氢离子放电得氢气,设生成气体物质的量为x,
A电极反应式为:
2H2O-4e-=O2↑+4H+
4x x
B电极反应式为:
Cu2++2e-=Cu; 2H++2e-=H2↑
0.1 0.2 2x x
根据得失电子守恒可得,0.2+2x=4x,解得x=0.1mol,则乙中A极析出的气体在标准状况下的体积为2.24L;
故答案为:2.24L。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】以下是反应A(g) + 3B(g) 2C(g) + 2D(g) 在四种不同情况下的反应速率,反应速率最大的是
A. υ(A)=0.45mol·L-1·s-1B. υ(B)=0.6mol·L-1·s-1
C. υ(C)=0.4mol·L-1·s-1D. υ(D)=0.45mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列六种物质:![]() 、
、![]() 、CaO、MgO、
、CaO、MgO、![]() 、
、![]() .
.
(1)按照不同的分类标准,它们中有一种物质与其他物质有明显的不同,请找出这种物质,并写出分类的依据.① ______②______.
(2)从反应中有无离子参加,可以将化学反应分为离子反应和非离子反应,![]() 与水反应的离子方程式是______.
与水反应的离子方程式是______.
(3)从上述氧化物中分别找出两种能相互反应的物质,写出一个非氧化还原反应的方程式和一个氧化还原反应的方程式,______.
(4)虽然分类的方法不同,但离子反应和氧化还原反应之间存在着一定的关系,请用简单的图示方法表示二者之间的关系:______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 肼(N2H4)具有强还原性,可用作火箭燃料、抗氧剂等。
(1)肼可以由氨气反应制得,已知部分化学键键能如下表所示:
化学键 | H—H | N≡N | N—H |
键能/kJ·molˉ1 | a | b | c |
①工业上合成氨的反应N2(g)+3H2(g)![]() 2NH3(g) ΔH=____ kJ·mol-1
2NH3(g) ΔH=____ kJ·mol-1
②合成氨反应的活化能很大,能加快反应速率但不改变反应活化能的方法是____。
(2)肼作火箭燃料与二氧化氮反应生成氮气和水。已知部分反应热化学方程式如下:
N2(g)+O2(g)=2NO(g) ΔH=+183 kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=-116.2 kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出肼作火箭燃料时反应的热化学方程式____。
(3)肼-空气燃料电池是一种环保型燃料电池,结构如图所示;

①肼-空气燃料电池的负极反应式为____。
②全钒液流可充电电池结构如图所示,将肼-空气燃料电池的A极与全钒液流可充电电池的C极相连,B极与D极相连,写出阴极的电极反应式____。
(4)肼可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。与使用Na2SO3处理水中溶解的O2相比,肼的优点是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为![]() 时,在三个容积均为
时,在三个容积均为![]() 的恒容密闭容器中仅发生反应:
的恒容密闭容器中仅发生反应:![]() 正反应吸热
正反应吸热![]() 。实验测得:
。实验测得:![]() ,
,![]() ,
,![]() 、
、![]() 为速率常数,受温度影响。平衡常数
为速率常数,受温度影响。平衡常数![]() 是用平衡分压代替平衡浓度计算,分压
是用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数。下列说法不正确的是
物质的量分数。下列说法不正确的是![]()
![]()
容器 编号 | 物质的起始浓度 | 物质的平衡浓度 | ||
|
|
|
| |
Ⅰ |
| 0 | 0 |
|
Ⅱ |
|
|
| |
Ⅲ | 0 |
|
| |
A.达平衡时,容器Ⅱ中![]() 比容器Ⅰ中的小
比容器Ⅰ中的小
B.容器Ⅱ反应达平衡前,![]()
C.起始时容器Ⅰ中总压强为![]() ,则
,则![]() 时该反应的平衡常数
时该反应的平衡常数![]() kPa
kPa
D.当温度改变为![]() 时,若
时,若![]() 则
则![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G具有镇痛、消炎等药理作用,其合成路线如下:

(1)E中官能团的名称为____、____。
(2)B→C、E→F的反应类型分别为____、____。
(3)M的结构简式为____。
(4)写出同时满足下列条件的C的一种同分异构体的结构简式:____。
Ⅰ.既能发生银镜反应,也能发生水解反应;
Ⅱ.与NaOH溶液共热后所得产物之一含三种化学环境不同的氢,且能与金属钠反应。
(5)请写出以乙烯、丙烯和PPh3为原料制备(CH3)2C=CH-CH=C(CH3)2的合成路线流程图(无机试剂任用,合成路线流程图例见本题题干)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用硫铁矿烧渣(主要成分为![]() 、
、![]() 、FeO、
、FeO、![]() 等)为原料来制取氧化铁。
等)为原料来制取氧化铁。

请回答下列问题
(1)酸溶过程中发生反应的离子方程式是:______;
(2)为了提高酸浸时的速率,除了适当增大硫酸的浓度外,还可以采取的措施有:______![]() 写出两条
写出两条![]() ;
;
(3)检验步骤Ⅲ反应后的溶液中金属阳离子的试剂是:______;
(4)步骤Ⅴ中,![]() 达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+)为1.0×10-5mol/L,是判断所得
达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+)为1.0×10-5mol/L,是判断所得![]() 中是否混有
中是否混有![]() ______
______![]() 填是或否
填是或否![]() ,请通过简单计算说明理由(已知Ksp[Fe(OH)2]= 4.9×10-17)______;
,请通过简单计算说明理由(已知Ksp[Fe(OH)2]= 4.9×10-17)______;
(5)步骤Ⅴ反应成![]() 的离子反应方程式:______;
的离子反应方程式:______;
(6)欲测定硫铁矿烧渣中Fe元素的质量分数,称取wg样品,充分酸溶、水溶后过滤,向滤液中加入足量的![]() ,充分反应后加入NaOH溶液至不再产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称的残留固体为ng。该样品中Fe元素的质量分数为______
,充分反应后加入NaOH溶液至不再产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称的残留固体为ng。该样品中Fe元素的质量分数为______![]() 用w、n的代数式表示
用w、n的代数式表示![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在调节好pH和![]() 浓度的废水中加
浓度的废水中加![]() ,能氧化降解污染物。现用该方法降解污染物
,能氧化降解污染物。现用该方法降解污染物![]() ,控制
,控制![]() 、
、![]() 和
和![]() 的初始浓度相同,设计如下对比实验探究温度、pH对该降解反应速率的影响,测得
的初始浓度相同,设计如下对比实验探究温度、pH对该降解反应速率的影响,测得![]() 的浓度随时间变化的关系如下图。
的浓度随时间变化的关系如下图。

下列结论或推断不正确的是
A.实验①、②表明适当升高温度,降解反应速率增大
B.根据反应原理推断,温度过高,反而会使降解速率变慢
C.313K、![]() 时,在
时,在![]() 内,
内,![]() 的分解平均速率约为
的分解平均速率约为![]() mol/(L·s)
mol/(L·s)
D.室温下,实验过程中取样分析浓度可以采用迅速加碱调节溶液pH的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:MxFey(CN)z,研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子结构如图示,下列说法正确的是( )
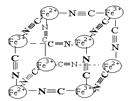
A. 该晶体是原子晶体
B. M的离子位于上述立方体的面心,呈+2价
C. M的离子位于上述立方体的体心,呈+1价,且M+空缺率(体心中没有M+的占总体心的百分比)为50%
D. 晶体的化学式可表示为MFe2(CN)3,且M为+1价
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com