
【题目】现有下列五种有机物:①CH4、②CH2=CH2、③CH3CH2OH、④ CH3 CH2CH2 CH3 、⑤CH3COOH
请回答:
(1)写出⑤的官能团的名称______。
(2)与①互为同系物的是______(填序号)。
(3)写出④ 的同分异构体的结构简式________________。
(4)写出与②发生加成反应生成乙烷的化学方程式_________________________。
(5)③与⑤发生反应的化学方程式______________________。
【答案】 羧基 ④ CH3 CH (CH3 )CH3 ![]() CH3COOH+CH3CH2OH
CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
【解析】从结构简式可知,①CH4甲烷属于烷烃,②CH2=CH2属于烯烃,官能团为碳碳双键,③CH3CH2OH属于醇,官能团为羟基,④ CH3CH2CH2CH3属于烷烃,⑤CH3COOH属于羧酸,官能团为羧基。以此分析。
(1) ⑤的官能团的名称为羧基,本题答案为:羧基;
(2) ①CH4和④ CH3CH2CH2CH3都属于烷烃,结构相似,分子组成相差3个CH2原子团,互为同系物,本题答案为④;
(3) CH3CH2CH2CH3为正丁烷,它的同分异构体为异丁烷CH3CH(CH3)CH3;
(4)乙烯CH2=CH2和氢气发生加成反应生成乙烷,化学方程式为:
![]() ;
;
(5)CH3CH2OH与CH3COOH在浓硫酸加热条件下,发生反应生成乙酸乙酯和水,化学方程式
CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O。
CH3COOCH2CH3+H2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是
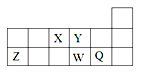
A. 离子半径的大小顺序为:r(W2-)>r(Q-)>r(Y2-)>r(Z3+)
B. 元素W的最高价氧化物对应水化物的酸性比Q的强
C. 元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键
D. X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应原理对于生产、生活及环境保护具有重要意义。请回答下列问题:
(1)常温下,物质的量浓度均为0.1 mol·L-1的四种溶液①NH4NO3 ②CH3COONa ③(NH4)2SO4 ④Na2CO3,pH从大到小排列顺序为_________________(填序号)。
(2)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如下图所示。
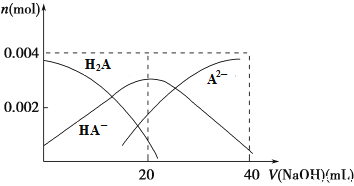
则当v(NaOH)=20 mL时,溶液中离子浓度大小关系:________,水的电离程度比纯水________(填“大”、“小”或“相等”)。
(3)含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol·L-1的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
①该废水中加入绿矾(FeSO4·7H2O)和H+,发生反应的离子方程式为________________________。
②若处理后的废水中残留的c(Fe3+)=2.0×10-13mol·L-1,则残留的Cr3+的浓度为___________。(已知:Ksp[Fe(OH)3)]=4.0×10-38, Ksp[Cr(OH)3]=6.0×10-31)
(4)利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“ Na-CO2”电池,以钠箔
和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 ![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
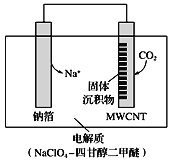
①放电时,正极的电极反应式为_____________________________。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e- 时,两极的质量差为______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应X(g)+ 3Y(g)![]() 2Z(g)达到平衡的标志是
2Z(g)达到平衡的标志是
A. Z生成的速率与X消耗的速率相等
B. 单位时间生成a mol X,同时生成3a mol Y
C. X、Y、Z的浓度不再变化
D. X、Y、Z的分子数比为1∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列各组微粒或物质:
A. O2和O3 B.![]() 和
和![]() C.
C. 
D. 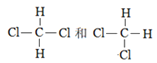 E.
E. 
(1)互为同位素的是________(填序号,下同);属于同系物的是__________;属于同一种物质的是______________;互为同分异构体的是_______________。
(2)E组中的两种物质的名称分别是________________、_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组研究溶液中Fe2+的稳定性,进行如下实验,观察,记录结果。
实验Ⅰ
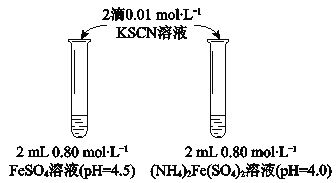
物质 | 0 min | 1min | 1h | 5h |
FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
(NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
(1)溶液的稳定性:FeSO4_______(NH4)2Fe(SO4)2(填“>”或“<”)
(2)结合离子方程式解释FeSO4溶液中加入KSCN溶液后变红的原因____________。
(3)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性。进行实验II,否定了该观点,补全该实验。
操作 | 现象 |
取_______,加_______,观察。 | 与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同。 |
(4)乙同学提出实验Ⅰ中两溶液的稳定性差异是溶液酸性不同导致,进行实验III:分别配制0.80 mol·L-1 pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
资料显示:亚铁盐溶液中存在反应:4Fe2++O2+10H2O ![]() 4Fe(OH)3+8H+。
4Fe(OH)3+8H+。
由实验III,乙同学可得出的结论是___________,原因是__________________。
(5)进一步研究在水溶液中Fe2+的氧化机理。测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如下图(实验过程中溶液温度几乎无变化)。反应初期,氧化速率都逐渐增大的原因可能是_____________。
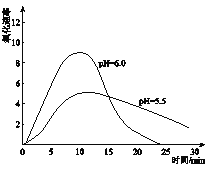
(6)综合以上实验,增强Fe2+稳定性的措施有_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门实用性的学科,以下叙述正确的是( )
A. 静置后的淘米水能产生丁达尔现象,这种“淘米水”是胶体
B. “洁厕灵”有效成分为盐酸,与漂白粉混合使用效果更佳
C. 活泼金属的冶炼常用电解方法,如电解NaCl溶液就可制备Na
D. 铝热反应中可得到铁,工业上可以利用该反应来大量生产铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤在燃烧时会产生SO2 , 造成环境污染.下列说法不正确的有( )
A.SO2是形成酸雨的主要气体
B.用碱液吸收燃煤废气可减少环境污染
C.用水溶解、过滤除去煤中的单质硫以减少SO2排放
D.往燃煤中混入生石灰,可减少SO2排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】牛通过吃草从草中获得化合物和元素,那么,牛和草体内的各种化学元素( )
A.种类差异很大,含量大体相同
B.种类和含量差异都很大
C.种类和含量都是大体相同的
D.种类大体相同,含量差异很大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com