
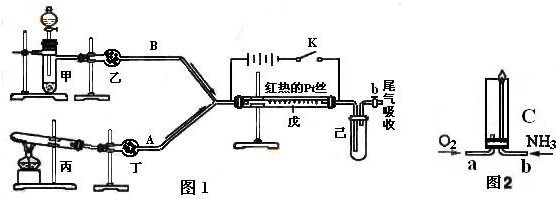
(10分)下列所示的装置中A为Zn,B为Cu,C、D均为碳棒。

则(1)A发生了____反应(填氧化或还原).C为____极。
(2)D极周围溶液中的现象____________________________________
原因是__________________________________________
(3)当A电极上的金属质量减少1.3g,则C电极上产生气体在标准状况下的体积为_________________________L。
(1)阳(1分) 氧化(1分) (2)溶液变红(2分) 由于H+放电,水
的电离平衡发生移动,使D极周围的溶液中pH>7,溶液显碱性,使酚酞变红。(3分)
(3)0.448(3分)
【解析】(1)根据装置特点可知,左侧是原电池,右侧是电解池。锌比铜活泼,所以锌是负极,失去电子,发生氧化反应。铜是正极,溶液中的氢离子在正极得到电子。C接电源的正极,因此C是阳极。
(2)D是阴极,溶液中的氢离子在阴极放电,生成氢气。由于H+放电,水的电离平衡发生移动,使D极周围的溶液中pH>7,溶液显碱性,使酚酞变红。
(3)A是锌失去电子,则转移电子是1.3g÷65g/mol×2=0.04mol。C是氯离子放电,产生氯气。根据电子得失守恒可知,生成氯气是0.02mol,标准状况下的体积是0.02mol×22.4L/mol=0.448L。


 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2013?江西模拟)(一)X、Y、Z、L、M五种元素的原子序数依次增大,X的阴离子与Y的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的二种元素,M是地壳中含量最高的金属元素.回答下列问题:
(2013?江西模拟)(一)X、Y、Z、L、M五种元素的原子序数依次增大,X的阴离子与Y的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的二种元素,M是地壳中含量最高的金属元素.回答下列问题: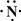 →
→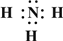
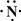 →
→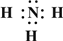


查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、C、D四种物质分别是由短周期元素组成的微粒,它们之间有如图所示的转化关系,且A是一种含有18电子的微粒,C是一种含有10电子的微粒.请完成下列各题:
已知A、B、C、D四种物质分别是由短周期元素组成的微粒,它们之间有如图所示的转化关系,且A是一种含有18电子的微粒,C是一种含有10电子的微粒.请完成下列各题:查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽省六安三中高一下学期期末考试化学B卷(带解析) 题型:填空题
(10分)下列所示的装置中A为Zn,B为Cu,C、D均为碳棒。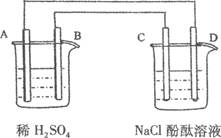
则(1)A发生了____反应(填氧化或还原).C为____极。
(2)D极周围溶液中的现象____________________________________
原因是__________________________________________
(3)当A电极上的金属质量减少1.3g,则C电极上产生气体在标准状况下的体积为_________________________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com