
����Ŀ������ֻʢ�в�ͬ��Һ���ձ�����μ���ϡ������������������Һ���ȣ�������CO2������HCl���ʵ����Ĺ�ϵ��ͼ(����CO2���ܽ��HCl�Ļӷ�)��

�����з�������ȷ�������( )
��Iͼ��Ӧ��Һ�е�����ΪNaHCO3
��IIͼ��Ӧ��Һ�е�����ΪNa2CO3��NaHCO3���Ҷ��ߵ����ʵ���֮��Ϊ1��1
��IIIͼ��Ӧ��Һ�е�����ΪNaOH��Na2CO3���Ҷ��ߵ����ʵ���֮��Ϊ1��1
��IVͼ��Ӧ��Һ�е�����ΪNa2CO3
A���٢� B���٢� C���ڢ� D���ڢ�
���𰸡�A
��������
�����������һ����NaOH��Һ���ձ���ͨ�벻ͬ����CO2���壬��������̼����ʱ��������NaOH��Na2CO3�Ļ�����NaOH��CO2ǡ����ȫ��Ӧʱ������ֻ��Na2CO3����������̼����ʱ���������ֻ��NaHCO3��Ҳ������Na2CO3��NaHCO3�Ļ�������ͼ�иտ�ʼ����HCl�Ͳ����˶�����̼���������ֻ����NaHCO3��������ȷ��������ͼ�п����յ���ȥ����һ����λ������˶�����̼��˵����ʱ̼���������һ����λ(�ζ����٣�̼���ƺ�����һ��һ��Ӧ����̼������)�������������������λ�Ű����ж�����̼��Ӧ������˵����Һ���ܵ�̼�������Ϊ������λ������һ����λ����֮ǰ̼��������ģ�����ԭ��Һ��̼���������̼�����������ȣ���c(Na2CO3)=c(NaHCO3)��������ȷ��������ͼ�п�����������������λ�������ſ�ʼ�������ݣ��Ҳ���������̼�����ĵ�����Ҳ��������λ��˵������ֻ��Na2CO3�������غ��֪��c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)����������������ͼ�п�����������������λ�������ſ�ʼ�������ݣ�˵��������NaOH��Na2CO3�Ļ���һ����λ�������NaOH��Ӧ���ڶ�����λ�������Na2CO3��Ӧ����NaHCO3������ͼ�пɿ�����NaHCO3��������һ����λ�����ᣬ�����������ƺ�̼���Ƶ���֮����1��1���������������Ϸ���֪�٢���ȷ���ۢ�����ѡA��


 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯��Ҫ�����ʵ���������������ɵ���( )��
A.CuO �� CuB.Fe �� FeCl2C.H2SO4�� SO2D.HNO3�� N2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������������ȷ����
A. ����NA����ԭ�ӵĺ����ڱ�״���µ����ԼΪ11.2L
B. ������32g�������������������У�������2NA����ԭ��
C. 56g���� ������ˮ������Ӧ��ת�Ƶĵ�����Ϊ3NA
D. 100mL0.1mol/L������Һ���е���������Ϊ0.01NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Na2CO3��Һ���Ƶ�NaHCO3��NaOH��ԭ����ͼ��ʾ��
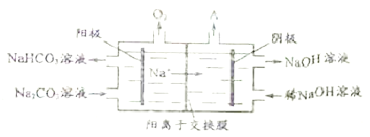
��1����������HCO3- �ĵ缫��ӦʽΪ________________________________����������������A�Ļ�ѧʽΪ______________��
��2������һ��ʱ����������Ƶ�NaHCO3��NaOH�����ʵ���֮��ԼΪ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ˮ�г�����һ������Cr2O72-��CrO42-�����ǻ�����༰��̬ϵͳ�����ܴ���Ҫ���б�Ҫ�Ĵ�����
������������Һ�д�������ƽ�⣺2CrO42-(��ɫ)+2H+![]() Cr2O72-(��ɫ)+H2O
Cr2O72-(��ɫ)+H2O
�ֶ�ij��ҵ��ˮ���м�Ⲣ��������������ش��������⣺
(һ)ȡ���ù�ҵ��ˮ��������и��ĺ�����
�����: ȡ25.00 mL��ˮ����������ϡ�����ữ��
�����������ĵ⻯����Һ��Cr2O72-+6I-+14H+![]() 2Cr3++3I2+7H2OȻ����뼸��ָʾ���������һ�������0.1000mol��L-1 Na2S2O3��Һװ���ʽ�ζ����У����еζ��������ζ�������£���I2+2Na2S2O3
2Cr3++3I2+7H2OȻ����뼸��ָʾ���������һ�������0.1000mol��L-1 Na2S2O3��Һװ���ʽ�ζ����У����еζ��������ζ�������£���I2+2Na2S2O3![]() 2NaI+Na2S4O6��
2NaI+Na2S4O6��
�ζ����� | Na2S2O3��Һ��ʼ����/mL | Na2S2O3��Һ�յ����/mL |
��һ�� | 1.02 | 19.03 |
�ڶ��� | 2.00 | 19.99 |
������ | 0. 20 | 18.20 |
�����:��������Ӧ����Һ����pH���ڡ����˵ȴ��������ճ�������Һ������ˮ����
��1����������ϡ�����ữ��Ŀ����_____________________________��
��2�����E���жϵζ��ﵽ�յ��������___________________________��
��3�����²�������ɷ�ˮ�и������ⶨֵƫ�ߵ���_________________��
A. �ζ��յ����ʱ�����ӵζ��ܵĿ̶�
B. ʢװ����Һ����ƿ������ˮϴ����δ�ô���Һ��ϴ
C. �ζ����յ����ʱ���ֵζ��ܼ��촦����һ����Һ
D. ��ϴ��δ�ñ�Һ��ϴ��ʽ�ζ���
��4��25.00mL��ˮ���ữ����Cr2O72- �����ʵ���Ϊ___________mol.
(������ԭ��������Cr2O72-��CrO42-
�÷����Ĺ�������Ϊ��

��5����˵���ڢٲ���Ӧ�ﵽƽ��״̬����_____________��������ĸ���ţ�
a. Cr2O72- ��CrO42- ��Ũ����ͬ
b. 2v(Cr2O72-)=v(CrO42-)
c. ��Һ����ɫ����
��6���ڢڲ��У���ԭ1molCr2O72-���ӣ���Ҫ________mol��FeSO4��7H2O��
��7�������£�Cr(OH)3���ܶȻ�Ksp=10-32��Ҫʹc(Cr3+)����10-5 mol��L-1����Һ��pHӦ����___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������¿ɽ�úת��Ϊˮú����ˮú������Ϊ����ȼ�ϣ��й��Ȼ�ѧ����ʽ������
��C(s)��H2O(g)��CO(g)��H2(g) ��H1����131.3 kJ/mol
��2CO(g)��O2(g)��2CO2(g) ��H2����566.0 kJ/mol
��2H2(g)��O2(g)��2H2O(g) ��H3����483.6 kJ/mol
����˵����ȷ����
A. ú�����ڻ�ʯȼ��
B. ��������CO��H2��ȫȼ��ʱ��ǰ�߷��ȶ�
C. ˮú����Ϊ����ȼ�ϣ���úֱ��ȼ����ȾС
D. �ɷ�Ӧ�ۿ���ȷ��H2��ȼ����Ϊ241.8 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. Na��H2O�ķ�Ӧ���ؼ��ķ��ȷ�Ӧ���÷�Ӧ���Է�����
B. AgCl��ͬŨ�ȵ�CaCl2��NaCl��Һ�е��ܽ����ͬ
C. FeCl3��MnO2���ɼӿ�H2O2�ֽ⣬ͬ�������¶��߶�H2O2�ֽ����ʵĸı���ͬ
D. Mg(OH)2��������Һ�д���ƽ�⣺Mg(OH)2(s)![]() Mg2��(aq)��2OH��(aq)���ù��������NH4Cl��Һ
Mg2��(aq)��2OH��(aq)���ù��������NH4Cl��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������У���ϡ������������²��ܷ���ˮ�ⷴӦ����
A. �� B. ��֬ C. ���� D. ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��ش����й�����ͼ��кͷ�Ӧ������:
��ijһԪ��HA ��NaOH��Һ�������ϣ��ֱ���б�Ţ١��ڡ��۵�ʵ�飬ʵ�����ݼ�¼�±�
��� | HA���ʵ���Ũ��(mol/L) | NaOH���ʵ���Ũ��(mol/L) | �����Һ��pH |
�� | 0.1 | 0.1 | pH=9 |
�� | c | 0.2 | pH=7 |
�� | 0.2 | 0.1 | pH>9 |
��ش�:
(1)���ݢ���ʵ������������ҺpH=9��ԭ����_____________(�����ӷ���ʽ��ʾ)��
(2)�����Һ������ˮ�������c (H+)_____0.1moI/LNaOH��Һ����ˮ�������c(H+)��(�>����<����=��)
(3)���ݢ���ʵ��������ڸ���Һ�����й�ϵʽ��ȷ����(�������ĸ)______��
A.c(Na+)+c(H+) =c(OH-) +c(A-)
B.c(Na+) =c(HA) +c(A-)
C.c (HA)+c(H+) =c(OH-)
D.c(Na+) +c(H+) =c(OH-) +c(A-) +c (HA)
(4)�������������c_________0.2mol/L (ѡ�>������<����=��)�������Һ������Ũ��c(A-)____c(Na+) (ѡ�>������<����=��)��
(5)�Ӣ���ʵ��������������Ũ���ɴ�С��˳����_________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com