
| A、电解精炼铜时是将电能转化为化学能,电路中每通过2mole-时,阳极就会溶解64克铜 |
| B、电解精炼铜时阳极为精铜,阴极为粗铜,电解过程中电解质不需要更换 |
| C、在铁质器皿上镀铝,电解质为熔融氧化铝,铁制器皿作阴极,阳极为铝棒 |
| D、电镀过程中电镀液需要不断更换 |


科目:高中化学 来源: 题型:
| n |
| 2 |
| 3n |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
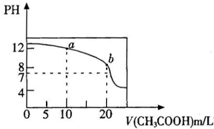 常温下,用0.1mol/L CH3COOH溶液滴定20mL O.1mol/L NaOH溶液的滴定曲线如图所示,则在混合后的溶液中下列粒子浓度的关系式干不正确的是(忽略溶液混合时体积变化)( )
常温下,用0.1mol/L CH3COOH溶液滴定20mL O.1mol/L NaOH溶液的滴定曲线如图所示,则在混合后的溶液中下列粒子浓度的关系式干不正确的是(忽略溶液混合时体积变化)( )| A、pH=8时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| B、a点时:c(OH-)=c(H+)+c(CH3COO-)+c(CH3COOH) |
| C、PH=7时:c(CH3COO-)+c(H+)=c(Na+)+c(OH-) |
| D、b点时:c(CH3COO-)+c(CH3COOH)=0.05mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1MgCl2溶液 |
| B、0.1mol?L-1KOH溶液 |
| C、0.1mol?L-1KCl溶液 |
| D、0.1mol?L-1NH4Cl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 完成下列各题:
完成下列各题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 硼镁矿 | 硼砂 | 硼酸 | 偏硼酸钠 |
| Mg2B2O5?H2O | Na2B4O7?10H2O | H3BO3 | NaBO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能说明NH3结合H+能力比H2O强:NH3+H2O?NH4++OH- |
| B、能说明氧化性H2O2>Fe3+:2Fe2++H2O2+2H+=2Fe3++2H2O |
| C、能说明盐酸的酸性比碳酸强:2HCl+CaCO3=CaCl2+H2O+CO2↑ |
| D、能说明CH3COOH是弱酸:CH3COO-+H2O?CH3COOH+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molNa+离子含有的核外电子数为NA |
| B、1mol的Cl2与足量的NaOH溶液反应转移的电子数为2NA |
| C、标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
| D、常温常压下,18克H2O含有2NA个氢原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com