
| A. | 若 Vl>V2,则说明HA的酸性比 HB的酸性强 | |
| B. | 中和后得到的两种溶液的pH均为 7 | |
| C. | 分别将两种酸溶液稀释10 倍后溶液的pH均为3 | |
| D. | 分别往等体积的两种酸溶液中加人足量锌粉,充分反应后产生的H2的体积相等 |
分析 pH 均为2的一元酸HA、HB,两种溶液中H+离子浓度相等,酸越弱则酸的浓度越大,与氢氧化钠反应时消耗的体积越小,所以消耗的体积大的酸性较强;两种酸的酸性不同,则必定有弱酸,所以与氢氧化钠反应后溶液显碱性;根据酸性不同结合选项分析.
解答 解:pH 均为2的一元酸HA、HB,两种溶液中H+离子浓度相等,酸越弱则酸的浓度越大,与氢氧化钠反应时消耗的体积越小,所以消耗的体积小的酸性较弱;两种酸的酸性不同,则必定有弱酸,所以与氢氧化钠反应后弱酸根离子水解溶液显碱性;
A、由以上分析可知,Vl>V2,则说明 HA 的酸性比 HB的酸性强,故A正确;
B、两种酸的酸性不同,则必定有弱酸,所以与氢氧化钠反应后弱酸根离子水解溶液显碱性,故B错误;
C、两种酸的酸性不同,当PH相同时,溶液稀释10 倍后,若是强酸 pH 为3,若是弱酸PH小于3,所以稀释后二者的PH不同,故C错误;
D、由于两种酸的浓度不同,所以与足量的Zn反应生成的氢气体积不同,故D错误;
故选A.
点评 本题考查酸性强弱的定性判断,题目难度中等,本题注意两种酸溶液中H+离子浓度相等,酸越弱则酸的浓度越大这一特点.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 主要玻璃仪器 | 试剂 |
| A | 鉴别Na2CO3和NaHCO3溶液 | 试管、胶头滴管 | 澄清石灰水 |
| B | 分离I2和CCl4的混合物 | 分液漏斗、烧杯 | 乙醇 |
| C | 实验室制取干燥的NH3 | 试管、酒精灯、带导管的橡皮塞 | NH4Cl、Ca(OH)2、碱石灰 |
| D | 测定NaOH溶液的浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、酚酞试剂、0.1000mol•L-1盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用铝制容器盛装稀硫酸 | B. | Na2O2可用作供氧剂 | ||
| C. | Fe2O3常用于制造红色油漆和涂料 | D. | Si可用于制造太阳能电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 六水氯化钙可用作食品干燥剂 | |
| B. | 葡萄糖注射液不能产生丁达尔效应,不属于胶体 | |
| C. | 为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂 | |
| D. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,与肺癌等疾病的发生不相关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9gD2O中含有的电子数为5NA | |
| B. | 4.5gSiO2晶体中含有的硅氧键的数目为0.15NA | |
| C. | 1molCH4分子中共价键总数为4NA | |
| D. | 7.1g C12与足量NaOH溶液反应转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
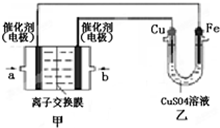
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由非金属元素形成的化合物都是共价化合物 | |
| B. | 酸、碱发生反应,只要生成1mol水放出的热量就相同 | |
| C. | 原电池工作时电流从正极流向负极 | |
| D. | 某物质溶于水得到的溶液可以导电,则该物质一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
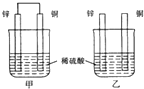
| A. | 两烧杯中溶液的pH均增大 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中铜片表面均无气泡产生 | D. | 甲、乙溶液均变蓝色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com