


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)0.1mol/LNa2CO3溶液呈
(1)0.1mol/LNa2CO3溶液呈查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2013-2014学年吉林省九校联合体高三第二次摸底考试理综化学试卷(解析版) 题型:填空题
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6] (NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。
① 基态Fe3+的M层电子排布式为 。
② 尿素(H2NCONH2)分子中C、N原子的杂化方式分别是 、 ;
③ 配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。 Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)

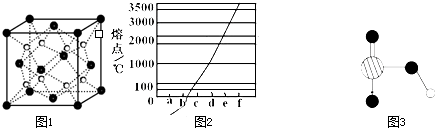
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如右图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a= cm。 (用含ρ、NA的计算式表示)
(3)下列说法正确的是 _。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
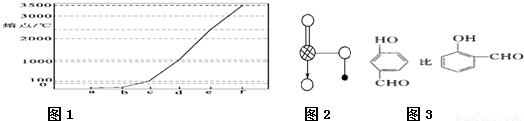
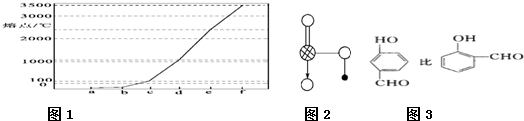
(4)图1是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。

① 图中d单质的晶体堆积方式类型是 。
② 单质a、b、f 对应的元素以原子个数比1:1:1形成的分子中含 个σ键, 个π键。
③ 图2是上述六种元素中的一种元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com