
【题目】在密闭容器中通人一定量的HI气体,使其在一定条件下发生反应:2HI ![]() H2+I2 (气) 。下列叙述中一定属于平衡状态的是:
H2+I2 (气) 。下列叙述中一定属于平衡状态的是:
A. HI、H2、I2的浓度相等
B. 混合气体的颜色不变化时
C. 混合气体的总压不变时
D. v(HI):v(H2):v(I2)=2:1:1时
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】下列关于铝及其氧化物与强碱溶液反应的说法中,正确的是
A. 都有H2O生成
B. 都有H2生成
C. 反应后铝元素主要以AlO2-的形式存在
D. 反应后铝元素主要以Al3+的形式存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,不能满足表中图示物质在一定条件下一步转化关系的组合为
组别 | X | Y | Z | W |
|
A | Al | AlCl3 | Al(OH)3 | Al2O3 | |
B | Na | Na2O2 | Na2CO3 | NaCl | |
C | Fe | FeCl2 | FeCl3 | Fe(OH)3 | |
D | Si | Na2SiO3 | H2SiO3 | SiO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物有丰富多彩的化学性质。回答下列问题:
(1)铁元素在周期表中的位置为第______周期_____族。
(2)FeCl3溶液可用于吸收尾气中的SO2,写出该反应的离子方程式:_________。
(3)某化学兴趣小组同学用如图装置,充分加热硫酸亚铁晶体(FeSO4·xH2O)至完全分解。

① 装置A中需持续通入N2,其目的是______________________________。
② 充分反应一段时间后,小组同学观察到实验现象为:装置A中残留有红棕色固体,装置B中固体变蓝,C中溶液褪色,请写出FeSO4分解的化学方程式:______________。
③ 装置D中干燥管的作用为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水AlCl3易升华,可用作有机合成的催化剂等。工业上以铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下:

(1) 氯化炉中Al2O3、Cl2和C反应的化学方程式为____________________。
(2)用Na2SO3溶液可除去冷却器排出的尾气中的Cl2,此反应的离子方程式为__________。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是________。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.32 g。
① 写出上述除杂过程中涉及的离子方程式___________、____________。
② AlCl3产品的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,向1体积pH=2的盐酸中加入10体积pH= 11 的氢氧化钠溶液,若所得溶液中pH是( )
A.约为2.3B.7C.约为10D.6.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙酮是一种常用的有机溶剂,可与水以任意体积比互溶,其密度小于lg/ml,沸点约55℃,分离水和丙酮最合理的方法是
A. 蒸发 B. 分液 C. 蒸馏 D. 过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室进行铁盐与亚铁盐相互转化的实验:
实验Ⅰ:将Fe3+转化为Fe2+
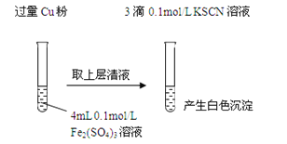
(1)Fe3+与Cu粉发生反应的离子方程式为:________________________________________。
(2)探究白色沉淀产生的原因,请填写实验方案:
实验方案 | 现象 | 结论 |
步骤1:取4mL_________mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 产生白色沉淀 | CuSO4与KSCN 反应产生了白色沉淀 |
步骤2:取_____________________________ | 无明显现象 |
查阅资料:ⅰ.SCN-的化学性质与I-相似 ⅱ.2Cu2++ 4 I-= 2CuI↓+ I2
则Cu2+与SCN-反应的离子方程式为________________________________________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL 0.1mol/L FeSO4溶液中加入1 mL 8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++ NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因_______________________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行
反应Ⅰ:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ__________(填“快”或“慢”)。
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是______________________________。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因__________________________________。
(5)丙认为若生成的NO与Fe2+不接触,溶液就不会出现棕色,请从以下提供的实验用品中选择合适的用品,设计实验方案,并画出实验装置图,标明试剂,实现Fe2+![]() Fe3+的转化,同时避免出现此异常现象。
Fe3+的转化,同时避免出现此异常现象。
实验用品:U形管、烧杯、导线、石墨棒若干、铁片若干、盐桥(装有含琼脂的KCl饱和溶液)、 0.1mol/L FeSO4溶液、8mol/L稀硝酸

____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com