
| A. | Na+、HCO3-、K+、OH- | B. | Fe2+、H+、SO42-、NO3- | ||
| C. | Fe3+、SCN-、NH4+、Cl- | D. | AlO2-、OH-、Na+、NH4+ |
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:选择题
| A. | 最高正价:X>Y>Z | B. | 酸性:H3ZO4>H2YO4>HXO4 | ||
| C. | 稳定性:HX>H2Y>ZH3 | D. | 非金属性:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 锌是负极,其质量逐渐减小 | B. | 氢离子在铜表面被还原 | ||
| C. | 电子从锌片经导线流向铜片 | D. | 电流从锌片经导线流向铜片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、乙醇、乙醛 | B. | 乙炔、乙醛、乙二醇 | ||
| C. | 甲醇、甲醚、甲醛 | D. | 乙烷、甘油、乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
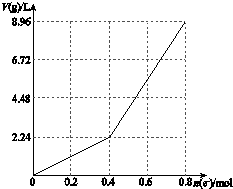 以石墨电极电解200mL CuSO4溶液,电解过程中电子转移物质的量n(e-)与产生气体体积V(g)(标准状况)的关系如图所示.下列说法中,正确的是( )
以石墨电极电解200mL CuSO4溶液,电解过程中电子转移物质的量n(e-)与产生气体体积V(g)(标准状况)的关系如图所示.下列说法中,正确的是( )| A. | 电解前CuSO4溶液的物质的量浓度为2 mol/L | |
| B. | 电解后所得溶液中c(H+)=1 mol/L | |
| C. | 当n(e-)=0.6 mol时,V(H2):V(O2)=2:3 | |
| D. | 向电解后的溶液中加入16 g CuO,则溶液可恢复为电解前的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| “嫦娥一号”发射火箭燃料 | 液氢(H2) | ①2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1 ②2H2(l)+O2(l)═2H2O(g)△H=-482.6kJ•mol-1 |
| 北京奥运会“祥云”火炬燃料 | 丙烷(C3H8) | ③C3H8(l)+5O2(g)═3CO2(g)+4H2O(g)△H=-2013.8kJ•mol-1 ④C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2221.5kJ•mol-1 |
| A. | -571.6 kJ•mol-1,-2221.5kJ•mol-1 | |
| B. | -285.8 kJ•mol-1,-2013.8 kJ•mol-1 | |
| C. | -285.8 kJ•mol-1,-2221.5 kJ•mol-1 | |
| D. | -241.3 kJ•mol-1,-2013.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片,同浓度盐酸做了下列平行实验:
某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片,同浓度盐酸做了下列平行实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com