
| A. | 乙醇的结构简式:C2H6O | |
| B. | Al3+的结构示意图: | |
| C. | CO2的电子式: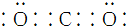 | |
| D. | NaHCO3的电离方程式:NaHCO3═Na++H++CO${\;}_{3}^{2-}$ |
分析 A.C2H6O是乙醇的分子式,结构简式应体现官能团是羟基;
B.铝是13号元素,最外层有3个电子,Al3是将原子的外层电子失去,次外层做最外层;
C.CO2是共价化合物,碳原子有四个电子分别和氧原子形成两对共用电子对;
D.碳酸氢钠为强电解质,完全电离,注意碳酸氢根离子为弱酸的酸式根离子不能拆.
解答 解:A.乙醇的官能团是羟基,乙醇的结构简式为:CH3CH2OH,故A错误;
B.铝是13号元素,最外层有3个电子,Al3+是将原子的外层电子失去,次外层做最外层,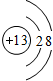 ,故B错误;
,故B错误;
C.CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ,故C正确;
,故C正确;
D.碳酸氢钠为强电解质,完全电离,电离方程式:NaHCO3═Na++HCO3-,故D错误;
故选C.
点评 本题考查化学用语的书写规范性,注意掌握常见物质的电子式、微粒的核外电子排布、酸式盐的电离方程式,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 选项 | X | Y |
| A | SO2 | H2S |
| B | CO2 | Cl2 |
| C | NH3 | CO2 |
| D | SO2 | Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Ba2+、N${O}_{3}^{-}$、Cl- | B. | Na+、N${H}_{4}^{+}$、S${O}_{4}^{2-}$、Cl- | ||
| C. | Na+、H+、C${O}_{3}^{2-}$、N${O}_{3}^{-}$ | D. | Na+、K+、Mn${O}_{4}^{-}$、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. | 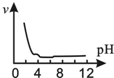 | D. | 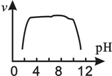 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Mg转变为Mg2+失去的电子数目为NA | |
| B. | 常温常压下,22.4 L O2含有的分子数目为NA | |
| C. | 1 mol•L-1KOH溶液中含有的钾离子数目为NA | |
| D. | 标准状况下,22.4 L CO2、CO的混合气中含有的碳原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若废水中c(Cl-)<2[c(Fe2+)+c(Cu2+)],则不可能存在Fe3+ | |
| B. | 向废水中加适量盐酸,滴加KSCN溶液,溶液变红,说明废水中含有Fe3+ | |
| C. | 经测定一定量的废水中n(Cu2+)=0.02 mol,n(Fe2+)+n(Fe3+)=0.02 mol,则该一定量的废水中0 mol≤n(Cl-)≤0.1 mol | |
| D. | 取10 mL废水,通入标况下Cl2 22.4 mL恰好完全反应.然后调节pH,使溶液中的铁元素全部转化为Fe(OH)3沉淀,经过滤、洗涤、灼烧,冷却后称重得0.32 g,则废水中c(Fe3+)=0.02 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
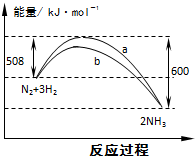
| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ•mol-1 | |
| B. | 向一密闭容器中加入1molN2和3molH2充分反应后,放出92kJ热量 | |
| C. | b曲线可能是加入催化剂时的能量变化曲线 | |
| D. | 加入正催化剂可增大正反应速率,降低逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com