
”¾»Æѧ-Ń”ŠŽ5£ŗÓŠ»ś»Æѧ»ł“””æ²æ·Ö¹ūŹßÖŠŗ¬ÓŠĻĀĮŠ³É·Ö£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
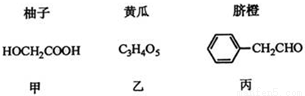
ŅŃÖŖ£ŗ
¢Ł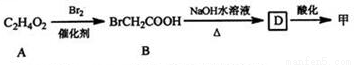
¢Ś1molŅŅĻūŗÄNaHCO3µÄĪļÖŹµÄĮæŹĒ¼×µÄ2±¶
¢Ū
£Ø1£©¼×æÉÓÉŅŃÖŖ¢ŁµĆµ½”£
¢Ł¼×ÖŠŗ¬ÓŠ²»±„ŗĶ¼üµÄ¹ŁÄÜĶÅĆū³ĘĪŖ £¬æÉŅŌ±ķÕ÷ÓŠ»ś»ÆŗĻĪļÖŠ“ęŌŚČĪŗĪ¹ŁÄÜĶŵÄŅĒĘ÷ŹĒ ”£
¢ŚA”śBĪŖČ”“ś·“Ó¦£¬AµÄ½į¹¹¼ņŹ½ĪŖ ”£
¢ŪB”śDµÄ»Æѧ·½³ĢŹ½ĪŖ ”£
£Ø2£©ŅŅŌŚŅ»¶ØĢõ¼žĻĀÉś³ÉĮ“ד֬ĄąÓŠ»śøß·Ö×Ó»ÆŗĻĪļ£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ ”£
£Ø3£©Óɱū¾ĻĀĮŠĶ¾¾¶æɵĆŅ»ÖÖÖŲŅŖµÄŅ½Ņ©ŗĶĻćĮĻÖŠ¼äĢåJ(²æ·Ö·“Ó¦Ģõ¼žĀŌČ„)£ŗ
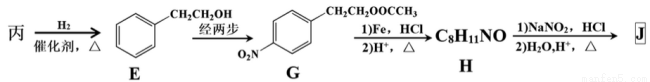
¢Ł¼ģŃé±ūÖŠ¹ŁÄÜĶÅµÄŹŌ¼ĮŹĒ £¬·“Ó¦µÄĻÖĻóŹĒ ”£
¢Ś¾E”śG”śH±£»¤µÄ¹ŁÄÜĶÅŹĒ £¬¾Ż“ĖĶĘ³öE”śGĮ½²½·“Ó¦ĀŌČ„µÄ·“Ó¦ĪļæÉÄÜĪŖ£ŗµŚŅ»²½ £¬µŚ¶ž²½ ”£
¢ŪJÓŠ¶ąÖÖĶ¬·ÖŅģ¹¹Ģ唣Ęä֊ijŅģ¹¹ĢåL³ŹĮ“דĒŅ²»“ęŌŚÖ§Į“£¬LÖŠµÄ¹ŁÄÜĶŶ¼ÄÜÓėH2·¢Éś¼Ó³É·“Ó¦£¬LŌŚŗĖ“Ź²ÕńĒāĘ×ÉĻĻŌŹ¾ĪŖĮ½×é·å£¬·åĆ껿±ČĪŖ3£ŗ2£¬ŌņLµÄ½į¹¹¼ņŹ½ĪŖ (Ö»Š“Ņ»ÖÖ)”£

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğÉĀĪ÷Ź”ø߶žÉĻĘŚÖŠ»Æѧ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠĪļÖŹ½ųŠŠŅ»ĀČČ”“śŗó£¬Ö»ÄÜÉś³ÉČżÖÖ·Šµć²»Ķ¬µÄÓŠ»ś²śĪļµÄŹĒ( )
A£®(CH3)2CH(CH2)2CH3 B£®C(CH3)3
C£®(CH3)3CCH2CH3 D£®(CH3)2CHCH(CH3)2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģɽ¶«Ź”ČÕÕÕŹŠøßČżÉĻѧʌʌ֊»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
ÓĆ·śÅšĖį£ØHBF4£¬ŹōÓŚĒæĖį£©“śĢęĮņĖį×÷ Ē¦Šīµē³ŲµÄµē½āÖŹČÜŅŗ£¬æÉŹ¹Ē¦Šīµē³ŲŌŚµĶĪĀĻĀ¹¤×÷Ź±µÄŠŌÄÜøüÓÅĮ¼£¬·“Ó¦·½³ĢŹ½ĪŖPb+PbO2+4HBF4
Ē¦Šīµē³ŲµÄµē½āÖŹČÜŅŗ£¬æÉŹ¹Ē¦Šīµē³ŲŌŚµĶĪĀĻĀ¹¤×÷Ź±µÄŠŌÄÜøüÓÅĮ¼£¬·“Ó¦·½³ĢŹ½ĪŖPb+PbO2+4HBF4 2Pb£ØBF4£©2+2H2O£¬ĘäÖŠPb£ØBF4£©2ĪŖæÉČÜÓŚĖ®µÄĒæµē½āÖŹ£¬ÓĆøĆĒ¦Šīµē³Ų·Ö±šµē½āAgNO3ČÜŅŗŗĶNa2SO3ČÜŅŗ£¬×°ÖĆČēĻĀĶ¼£¬a”¢b”¢c”¢dµē¼«²ÄĮĻ¾łĪŖŹÆÄ«£¬ĶصēŹ±aµē¼«ÖŹĮæŌö¼Ó”£
2Pb£ØBF4£©2+2H2O£¬ĘäÖŠPb£ØBF4£©2ĪŖæÉČÜÓŚĖ®µÄĒæµē½āÖŹ£¬ÓĆøĆĒ¦Šīµē³Ų·Ö±šµē½āAgNO3ČÜŅŗŗĶNa2SO3ČÜŅŗ£¬×°ÖĆČēĻĀĶ¼£¬a”¢b”¢c”¢dµē¼«²ÄĮĻ¾łĪŖŹÆÄ«£¬ĶصēŹ±aµē¼«ÖŹĮæŌö¼Ó”£
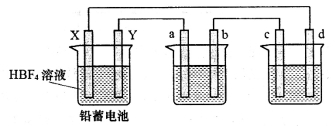
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©dµē¼«ĪŖøĆ×°ÖƵÄ___________¼«£¬¹¤×÷Ź±£¬øĆ³ŲÄŚdµē¼«ÉĻĪŽĘųĢå²śÉś£¬Š“³öøĆ³ŲÄŚµē½ā·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ_____________________”£
£Ø2£©øĆĒ¦Šīµē³Ų·ÅµēŹ±X¼«ø½½üpH_____________ £ØĢī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±£©£¬Õż¼«µÄµē¼«·“Ó¦Ź½ĪŖ______________________”£
£Ø3£©Ē¦Šīµē³Ų³äµēŹ±£¬Yµē¼«ÓėµēŌ“µÄ_________£ØĢī”°Õż¼«”±»ņ”°øŗ¼«”±£©ĻąĮ¬”£
£Ø4£©ĮķČ”Ņ»³£¹ęĒ¦Šīµē³Ų£ØÅØĮņĖį×÷µē½āÖŹČÜŅŗ£©ÓėøĆĒ¦Šīµē³ŲĶ¬Ź±·Åµē£¬µ±µēĀ·ÖŠ¾łĶØ ¹ż1 molµē×ÓŹ±£¬·Ö±šČ”ĻĀYµē¼«³ĘÖŲ£¬Į½µē¼«ÖŹĮæĻą²ī__________g”£
¹ż1 molµē×ÓŹ±£¬·Ö±šČ”ĻĀYµē¼«³ĘÖŲ£¬Į½µē¼«ÖŹĮæĻą²ī__________g”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģÄžĻÄøßČżÉĻѧʌµŚČż“ĪŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĶʶĻĢā
[»Æѧ---Ń”ŠŽ5£ŗÓŠ»ś»Æѧ»ł“”]
Ę«ĖÄĀČŅŅĶéŹĒŅ»ÖÖ³£¼ū»Æ¹¤ŌĮĻ£¬ŅŌĘ«ĖÄĀČŅŅĶéŗĶĻ©Ģž(C5H10)ĪŖŌĮĻŗĻ³ÉijÖÖĮłŌŖ»·õ„(C7H10O4)µÄŗĻ³ÉĀ·ĻßČēĻĀ£ŗŅŃÖŖ£ŗŅ»øöĢ¼Ō×ÓÉĻĮ¬½Ó2øö”ŖOH²»ĪČ¶Ø£¬ČŻŅ×ĶŃĖ®±ä³É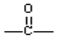

£Ø1£©»ÆŗĻĪļIIÖŠÄÜÓėÄÜÓė½šŹōÄĘ·“Ó¦µÄ¹ŁÄÜĶÅĆū³ĘĪŖ_________________
£Ø2£©»ÆŗĻĪļIVŗĻ³É»ÆŗĻĪļVµÄ·“Ó¦ĄąŠĶĪŖ______________»ÆŗĻĪļVŗĻ³É»ÆŗĻĪļVI·“Ó¦ĄąŠĶĪŖ_________________
£Ø3£©Š“³öÓÉ»ÆŗĻĪļVIŗĻ³É»ÆŗĻĪļVIIµÄ·“Ó¦·½³ĢŹ½________________________”£
£Ø4£©ÓŠ»śĪļRŹĒ»ÆŗĻĪļIVµÄĶ¬·ÖŅģ¹¹Ģ壬RÄÜŹ¹äåĖ®ĶŹÉ«£¬ĒŅĘäŗĖ“Ź²ÕńĒāĘ×ÖŠÓŠ4×é·å£¬ÓŠ»śĪļRµÄ½į¹¹¼ņŹ½ĪŖ_________________£¬øĆĮłŌŖ»·õ„(C7H10O4)µÄ½į¹¹¼ņŹ½ĪŖ_________________
£Ø5£©²ĪÕÕÉĻŗĻ³ÉĀ·Ļߣ¬Éč¼ĘŅŌÓŠ»śĪļ( )ŗĶŅŅ¶ž“¼ĪŖŌĮĻŗĻ³É¾ŪŅŅ¶žĖįŅŅ¶ž“¼õ„µÄŗĻ³ÉĀ·Ļß”£____________________________”£
)ŗĶŅŅ¶ž“¼ĪŖŌĮĻŗĻ³É¾ŪŅŅ¶žĖįŅŅ¶ž“¼õ„µÄŗĻ³ÉĀ·Ļß”£____________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģÄžĻÄøßČżÉĻѧʌµŚČż“ĪŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŅŃÖŖA”¢B”¢D”¢E¾łĪŖ»Æѧ֊µÄ³£¼ūĪļÖŹ£¬ĖüĆĒÖ®¼äµÄ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾(²æ·Ö²śĪļĀŌČ„)£¬ŌņĻĀĮŠÓŠ¹ŲĪļÖŹµÄĶʶĻ²»ÕżČ·µÄŹĒ£Ø £©

A£®ČōAŹĒĢś£¬ŌņEæÉÄÜĪŖĻ”ĻõĖį
B£®ČōAŹĒCuO£¬EŹĒĢ¼£¬ŌņBĪŖCO
C£®ČōAŹĒNaOHČÜŅŗ£¬EŹĒCO2£¬ŌņBĪŖNaHCO3
D£®ČōAŹĒAlCl3ČÜŅŗ£¬EæÉÄÜŹĒ°±Ė®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģŗÓÄĻŹ”øßČżÉĻµŚČż“ĪÖÜæ¼»Æѧ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ČÜŅŗXÖŠŗ¬ÓŠÓŅ±ķÖŠµÄij5ÖÖ£¬ĒŅĘäÅØ¶Č¾łĪŖ 0.1mol£ÆL(²»æ¼ĀĒĖ®µÄµēĄėÓėĄė×ÓĖ®½ā)”£ĻņXČÜŅŗ¼ÓČė×ćĮæĻ”ŃĪĖį£¬ÓŠĪŽÉ«ĘųĢåÉś³É£¬¾·ÖĪö·“Ó¦Ē°ŗóŅõĄė×ÓÖÖĄąĆ»ÓŠ±ä»Æ”£ĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ
ŃōĄė×Ó | Na+”¢Ca2+”¢Fe2+”¢Al3+”¢Fe3+”¢Mg2+ |
ŅõĄė×Ó | OH-”¢HCO3-”¢CO32-”¢Cl-”¢NO3-”¢SO42- |
A£®XČÜŅŗÖŠ²»æÉÄÜŗ¬ÓŠHCO3-»ņCO32-
B£®Éś³ÉĪŽÉ«ĘųĢåµÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ3Fe2+ +NO3-+4H+=3Fe3++NO+2H2O
C£®øł¾ŻµēŗÉŹŲŗć£¬ŌČÜŅŗÖŠŅ»¶Øŗ¬Mg2+
D£®XČÜŅŗÖŠŅ»¶Øŗ¬3ÖÖŃōĄė×Ó”¢2ÖÖŅõĄė×Ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģŗÓ±±Ź”øßČżÉĻ11ŌĀŌĀæ¼»Æѧ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
ijµŲĆŗķ·ŹÆ¾Ō¤“¦Ąķŗóŗ¬SiO2(63%)”¢Al2O3(25%)”¢Fe2O3(5%)¼°ÉŁĮæøĘĆ¾µÄ»ÆŗĻĪļµČ£¬Ņ»ÖÖ×ŪŗĻĄūÓĆ¹¤ŅÕÉč¼ĘČēĻĀ£ŗ
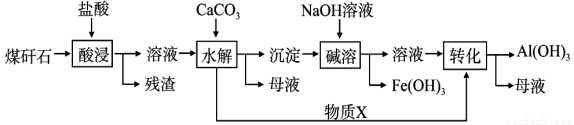
(1)”°Ėį½ž”±¹ż³ĢÖŠÖ÷ŅŖ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ___________”¢___________”£
(2)”°Ėį½ž”±Ź±£¬Ģįøß½ž³öĖŁĀŹµÄ¾ßĢå“ėŹ©ÓŠ___________”¢___________”£(Š“³öĮ½øö)
(3)”°¼īČÜ”±µÄÄæµÄŹĒ___________”£Īļ ÖŹXµÄ»ÆѧŹ½ĪŖ___________”£
ÖŹXµÄ»ÆѧŹ½ĪŖ___________”£
(4)“ÓĮ÷³ĢÖŠ·ÖĄė³öĄ“µÄFe(OH)3³ĮµķæÉŌŚ¼īŠŌĢõ¼žĻĀÓĆKClOČÜŅŗ“¦Ąķ£¬ÖʱøŠĀŠĶĖ®“¦Ąķ¼ĮøßĢśĖį¼Ų(K2FeO4)£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ___________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģ¹óÖŻŹ”øßČżÉĻÄ£ÄāĖÄ»Æѧ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
X”¢Y”¢M”¢NŹĒ¶ĢÖÜĘŚĒŅŌ×ÓŠņŹżŅĄ“ĪŌö“óµÄÖ÷×åŌŖĖŲ”£ŅŃÖŖXµÄ×īĶā²ćµē×ÓŹżŹĒµē×Ó²ćŹżµÄ3±¶£¬X”¢MĶ¬Ö÷×壬YµÄŌ×ÓŌŚ¶ĢÖÜĘŚÖ÷×åŌŖĖŲÖŠŌ×Ó°ė¾¶×ī“ó”£ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ£Ø £©
A. M”¢NµÄ¼ņµ„Ąė×Ó°ė¾¶£ŗr£ØN-£©£¾r£ØM2©£©
B. ĘųĢ¬Ēā»ÆĪļµÄĪČ¶ØŠŌ£ŗM£¾X
C. X”¢YŠĪ³ÉµÄ»ÆŗĻĪļÖŠÖ»ÓŠĄė×Ó¼ü
D. X”¢Y”¢NĖłŠĪ³É»ÆŗĻĪļµÄĖ®ČÜŅŗæÉÄÜĻŌÖŠŠŌ»ņ¼īŠŌ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģøŹĖąŹ”øßČżÉĻ12ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ijČÜŅŗæÉÄÜŗ¬ÓŠK+”¢NH4£«”¢Fe2£«”¢Fe3+”¢SO42-”¢CO32-”¢SiO32-”¢Cl-”¢I-ÖŠµÄ¼øÖÖĄė×Ó£¬¼ŗÖŖø÷Ąė×ÓµÄÅØ¶Č¾łĪŖ0.2mol/L£¬½ųŠŠČēĻĀŹµŃé£Ø²»æ¼ĀĒŃĪĄąµÄĖ®½ā¼°Ė®µÄµēĄė£©£ŗ
¢ŁČ”ÉŁĮæøĆČÜŅŗ£¬¼ÓČė×ćĮæĻ”ĮņĖį£¬ĪŽĆ÷ĻŌĻÖĻó”£
¢ŚČ”¢Ł·“Ó¦ŗóµÄČÜŅŗ£¬¼ÓČė×ćĮæÅØNaOHČÜŅŗ£¬×īÖÕµĆµ½ŗģŗÖÉ«³Įµķ£¬²¢°éÓŠ“Ģ¼¤ŠŌĘųĪ¶ĘųĢå²śÉś”£
ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
A£®øł¾ŻŹµŃé¢ŁæÉÖŖČÜŅŗÖŠ²»“ęCO32-”¢SiO32-
B£®øĆČÜŅŗÖŠæĻ¶Ø“ęŌŚNH4£«”¢Fe2+
C£®øĆČÜŅŗÖŠÖĮÉŁŗ¬ÓŠ4ÖÖĄė×Ó
D£®ĮķČ”øĆČÜŅŗ£¬¼ÓČėŹŹĮæĀČĖ®ŗĶµķ·ŪČÜŅŗ£¬ČōČÜŅŗĻŌĄ¶É«£¬¼“æÉČ·¶ØøĆČÜŅŗÖŠÖ»ŗ¬NH4£«”¢Fe2£«”¢Fe3+”¢SO42-”¢I-
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com