
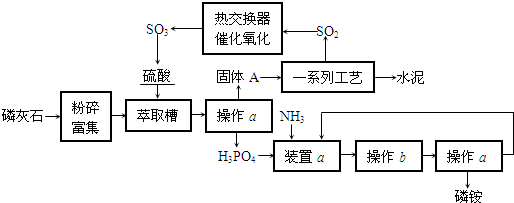
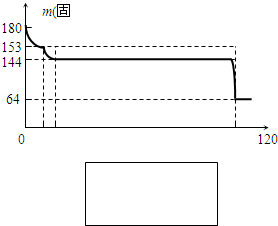
(15分)在实验室中某实验小组同学关于硫酸铜的制取和应用,设计了以下实验:
(1)铜与浓硫酸反应,实验装置如图所示。

①装置A中发生反应的化学方程式为 ;
②上图装置中导管B的作用你认为可能是(写出一种) 。
(2)为符合绿色化学的要求,某同学进行如下设计:将铜粉在 (填仪器名称)中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应,反应后溶液经过 、 、过滤、洗涤、干燥,即可得到产品CuSO4·5H2O晶体,干燥需要控制温度小于100℃,若温度过高,则会导致 。
(3)将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量:FeSO4作催化剂,即发生反应,生成硫酸铜。其反应过程的第2步是:2Fe3++Cu=2Fe2++Cu2+,请写出其第l步反应的离子方程式 。
(4)制取的CuSO4溶液和“另一物质”在40-50℃混合时生成了一种难溶物质氢化亚铜(CuH)。将CuH溶解在稀盐酸中时生成了一种气体,这种气体是 ,经收集测定生成的该气体为标况下11.2 L,则被还原的离子得电子的物质的量是 (已知Cu+在酸性条件下发生反应2Cu+=Cu2++Cu)。
(1)①2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O
(2分)
CuSO4+SO2↑+2H2O
(2分)
②安全管;平衡气压;防倒吸;若连C的导气管堵塞时防止装置爆炸;拆除装置前,从B管口向A中鼓气使SO2被全部吸收。(写出一种即得分) (2分)
(2)坩埚 蒸发浓缩(加热蒸发) 冷却结晶 CuSO4·5H2O失去部分结晶水(各1分,共4分)
(3)4Fe2++O2+4H+=4Fe3++2H2O (2分)
(4)H2 (2分) 0.75 mol (3分)
【解析】本题考查硫酸铜的制取及硫酸铜的性质。(1)①铜与热的浓硫酸反应生成硫酸铜、二氧化硫和水,方程式为2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O②由于导管B与外界相通,故在试管中压强过大时,可做安全管;平衡气压;防倒吸;若连C的导气管堵塞时防止装置爆炸;拆除装置前,从B管口向A中鼓气使SO2被全部吸收。(2)灼烧物质一般在坩埚中进行,将铜粉全部转化为CuO, 再将氧化铜与稀硫酸反应,生成硫酸铜和水,不会产生二氧化硫,再将溶液经过蒸发浓缩,冷却结晶可得到CuSO4·5H2O晶体。干燥需要控制温度小于100℃,若温度过高,则会导致CuSO4·5H2O失去部分结晶水。(3)从第二步反应有Fe3+参加反应可知,第一步反应应该是Fe2+被氧化,O2被还原,则反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O(4)CuH中的氢为-1价,与盐酸(HCl)中氢为+1价,反应时生成H2,反应方程式为2CuH+2HCl=2CuCl2+2H2+Cu,则2H2~3e-,故收集标况下的H211.2 L,转移的电子数目为0.5mol×3/2=0.75mol。
CuSO4+SO2↑+2H2O②由于导管B与外界相通,故在试管中压强过大时,可做安全管;平衡气压;防倒吸;若连C的导气管堵塞时防止装置爆炸;拆除装置前,从B管口向A中鼓气使SO2被全部吸收。(2)灼烧物质一般在坩埚中进行,将铜粉全部转化为CuO, 再将氧化铜与稀硫酸反应,生成硫酸铜和水,不会产生二氧化硫,再将溶液经过蒸发浓缩,冷却结晶可得到CuSO4·5H2O晶体。干燥需要控制温度小于100℃,若温度过高,则会导致CuSO4·5H2O失去部分结晶水。(3)从第二步反应有Fe3+参加反应可知,第一步反应应该是Fe2+被氧化,O2被还原,则反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O(4)CuH中的氢为-1价,与盐酸(HCl)中氢为+1价,反应时生成H2,反应方程式为2CuH+2HCl=2CuCl2+2H2+Cu,则2H2~3e-,故收集标况下的H211.2 L,转移的电子数目为0.5mol×3/2=0.75mol。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
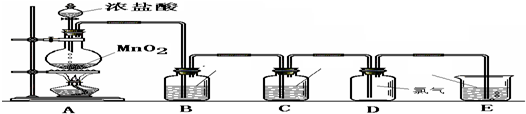
(15分)在实验室中某实验小组同学关于硫酸铜的制取和应用,设计了以下实验:
(1)铜与浓硫酸反应,实验装置如图所示。
①装置A中发生反应的化学方程式为 ;
②上图装置中导管B的作用你认为可能是(写出一种) 。
(2)为符合绿色化学的要求,某同学进行如下设计:将铜粉在 (填仪器名称)中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应,反应后溶液经过 、 、过滤、洗涤、干燥,即可得到产品CuSO4·5H2O晶体,干燥需要控制温度小于100℃,若温度过高,则会导致 。
(3)将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量:FeSO4作催化剂,即发生反应,生成硫酸铜。其反应过程的第2步是:2Fe3++Cu=2Fe2++Cu2+,请写出其第l步反应的离子方程式 。
(4)制取的CuSO4溶液和“另一物质”在40-50℃混合时生成了一种难溶物质氢化亚铜(CuH)。将CuH溶解在稀盐酸中时生成了一种气体,这种气体是 ,经收集测定生成的该气体为标况下11.2 L,则被还原的离子得电子的物质的量是 (已知Cu+在酸性条件下发生反应2Cu+=Cu2++Cu)。
查看答案和解析>>
科目:高中化学 来源:2012届河北省唐山市高三上学期期末统一考试理综试题化学试卷(解析版) 题型:单选题
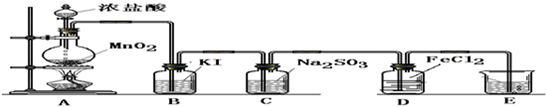
(15分)在实验室中某实验小组同学关于硫酸铜的制取和应用,设计了以下实验:
(1)铜与浓硫酸反应,实验装置如图所示。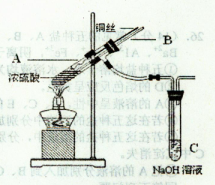
①装置A中发生反应的化学方程式为 ;
②上图装置中导管B的作用你认为可能是(写出一种) 。
(2)为符合绿色化学的要求,某同学进行如下设计:将铜粉在 (填仪器名称)中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应,反应后溶液经过 、 、过滤、洗涤、干燥,即可得到产品CuSO4·5H2O晶体,干燥需要控制温度小于100℃,若温度过高,则会导致 。
(3)将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量:FeSO4作催化剂,即发生反应,生成硫酸铜。其反应过程的第2步是:2Fe3++Cu=2Fe2++Cu2+,请写出其第l步反应的离子方程式 。
(4)制取的CuSO4溶液和“另一物质”在40-50℃混合时生成了一种难溶物质氢化亚铜(CuH)。将CuH溶解在稀盐酸中时生成了一种气体,这种气体是 ,经收集测定生成的该气体为标况下11.2 L,则被还原的离子得电子的物质的量是 (已知Cu+在酸性条件下发生反应2Cu+=Cu2++Cu)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com