
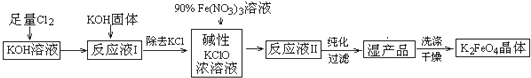
分析 已知:①2KOH+Cl2→KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2→5KCl+KClO3+3H2O(条件:温度较高)
③2Fe(NO3)3+2KClO+10KOH→2K2FeO4+6KNO3+3KCl+5H2O
流程分析可知足量氯气通入氢氧化钾溶液生成氯化钾、次氯酸钾和水,加入氢氧化钾与“反应液I”中过量的Cl2继续反应,生成更多的KClO
,为下一步反应提供反应物,除去氯化钾,在碱性KClO溶液中加入90%硝酸铁,反应的反应液Ⅱ,纯化过滤得到湿产品洗涤干燥得到高铁酸钾;
(1)由工艺流程及③可知,利用Fe(NO3)3与KClO制备K2FeO4,由信息②可知温度较高KOH与Cl2 反应生成的是KClO3;
(2)工业是利用电解饱和食盐水制取氯气;
(3)K2FeO4中铁元素化合价为+6价,高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂,起到杀菌消毒作用,形成胶体具有吸附悬浮杂质的作用;
(4)由工艺流程可知,反应液I中有过量的Cl2反应,生成更多的KClO;
(5)由工艺流程及③可知,从“反应液II”中分离出K2FeO4后,会有副产品KNO3、KCl.KNO3可用于化肥,炸药等;
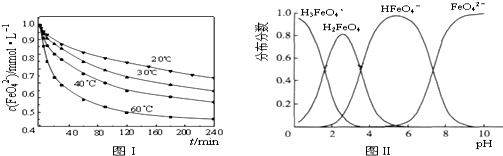
(6)由图1数据可知,将试样分别置于不同温度的恒温水浴中,来测定c(FeO42-)的变化,显然是确定温度对FeO42-浓度的影响情况;温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小;温度越高FeO42-浓度越小,正向反应是吸热反应;
(7)根据图象的内容来分析图象所描述的意义.
解答 解:(1)由工艺流程及③可知,利用Fe(NO3)3与KClO制备K2FeO4,由信息②可知温度较高KOH与Cl2 反应生成的是KClO3.由信息①可知,在低温下KOH与Cl2 反应生成的是KClO.故选择低温较低,
故答案为:温度较低;
(2)工业是利用电解饱和食盐水制取氯气.反应方程式为:2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
(3)K2FeO4中铁元素化合价为+6价,价态高,易得电子,表现强氧化性,生成的铁离子水解生成的氢氧化铁胶体能吸附悬浮杂质的作用,可以起到净水作用,
故答案为:氧化剂和净水剂;
(4)由工艺流程可知,反应液I中有过量的Cl2反应,加KOH固体的目的是与过量的Cl2继续反应,生成更多的KClO.
A、与过量的Cl2继续反应,生成更多的KClO,故A正确;
B、由信息②可知温度较高KOH与Cl2 反应生成的是KClO3,不利用KClO生成、浪费原料,故B错误;
C、由工艺流程及③可知,利用Fe(NO3)3与KClO制备K2FeO4,故C正确;
D、由信息可知,该条件下KClO3 不能转化为KClO,故D错误.
故选:AC;
(5)由工艺流程及③可知,从“反应液II”中分离出K2FeO4后,会有副产品KNO3、KCl.KNO3可用于化肥,炸药等,
故答案为:KNO3、KCl;KNO3是一种复合化肥,KNO3可用于化肥,炸药等;
(6)由图1数据可知,温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小,温度越高FeO42-浓度越小,正向反应是吸热反应,故答案为:探究温度对FeO42-浓度的影响;>;
(7)A、不同PH值时,溶液中铁元素的存在形态及种数不相同,比如在PH值等于6时,就只有两种形态,故A错误;
B、向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数先增大随后又减小,故B错误;
C、pH=6的这种溶液中,铁元素的存在形态有HFeO4-和FeO42-,加KOH溶液,只有HFeO4-能反应,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O,故C正确;
故答案为:C.
点评 本题考查学生阅读题目获取信息的能力、对工艺流程的理解与条件的控制、对物质的量浓度理解等,难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力,注意基础知识的掌握.


科目:高中化学 来源: 题型:解答题
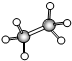 ;B的比例模型为
;B的比例模型为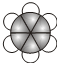 ;C是含氢量最大的有机物,分子结构为正四面体;D的相对分子质量为46,能与Na反应,但不能与NaOH溶液反应.
;C是含氢量最大的有机物,分子结构为正四面体;D的相对分子质量为46,能与Na反应,但不能与NaOH溶液反应. ,CCH4,DCH3CH2OH.
,CCH4,DCH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+) | B. | 醋酸电离的程度 | ||
| C. | 中和时所需 NaOH的量 | D. | 醋酸的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属元素原子最外层都只有1个电子 | |
| B. | 依Li、Na、K、Rb,单质熔沸点升高,密度增大 | |
| C. | 单质氧化性:F2>Cl2>Br2>I2 | |
| D. | 氢化物稳定性:HF>HCl>HBr>HI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (用电子式表示).
(用电子式表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 已知 | 类推 | |
| A | 将Fe加入CuSO4溶液中: Fe+Cu2+═Cu+Fe2+ | 将Na加入到CuSO4溶液中: 2Na+Cu2+═Cu+2Na+ |
| B | 向稀硫酸溶液中加入NaOH溶液至中性:H++OH-═H2O | 向稀H2SO4溶液中加入Ba(OH)2溶液至中性:H++OH-═H2O |
| C | 向有水垢的瓶胆内加入足量稀盐酸溶液: CaCO3+2H+═Ca2++CO2↑+H2O | 向有水垢的瓶胆内加入足量醋酸溶液: CaCO3+2H+═Ca2++CO2↑+H2O |
| D | 向Ca(OH)2溶液中通入过量CO2: CO2+OH-═HCO3- | 向Ca(OH)2溶液中通入过量SO2: SO2+OH-═HSO3- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 mol/L | B. | 0.3molL/(L•s) | C. | 0.6 molL/(L•s) | D. | 0.1 molL/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖浓度太浓 | B. | 加热时间不够 | C. | NaOH的量太少 | D. | CuSO4的量太少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com