
【题目】已知25 ℃,醋酸溶液中各微粒存在下述关系:K= ![]() =1.75×10-5,下列有关说法可能成立的是
=1.75×10-5,下列有关说法可能成立的是
A. 25 ℃条件下,向该溶液中加入一定量的盐酸时,K=8×10-5
B. 25 ℃条件下,向该溶液中加入一定量的盐酸时,K=2×10-4
C. 标准状况下,醋酸溶液中K=1.75×10-5
D. 升高到一定温度,K=7.2×10-5
科目:高中化学 来源: 题型:
【题目】(l)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有______个。
②LiBH4由Li+和BH4-构成,BH4-的空间构型是________,B原子的杂化轨道类型是_____________。
③某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如下表所示:
I1/ kJ·mol-1 | I2/ kJ·mol-1 | I3/ kJ·mol-1 | I4/ kJ·mol-1 | I5/ kJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是_____ (填元素符号),判断理由为________________________。
(2)铜晶体中铜原子的堆积方式如图24所示,铜晶体中原子的堆积模型属于______。

(3)A原子的价电子排布式为3s23p5,铜与A形成化合物的晶胞如图25所示(黑点代表铜原子)。
①该晶体的化学式为______________________。
②该化合物难溶于水但易溶于氨水,其原因是_______________________。此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为______________________。
③已知该晶体的密度为pg . cm-3,阿伏伽德罗常数为NA,已知该晶体中Cu原子和A原子之间的最短距离为体对角线的1/4,则该晶体中Cu原子和A原子之间的最短距离为______pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s) + H2O(g)==CO(g)+H2(g) ΔH1=a kJmol-1
②CO(g) + H2O(g)==CO2(g)+H2(g) ΔH2=b kJmol-1
③CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH3 =c kJmol-1
④2CH3OH(g) ==CH3OCH3(g)+H2O(g) ΔH4=d kJmol-1
A. 反应①②为反应③提供原料气
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)== ![]() CH3OCH3(g)+
CH3OCH3(g)+ ![]() H2O(1)的ΔH =
H2O(1)的ΔH =![]() kJmol-1
kJmol-1
D. 反应 2CO(g)+4H2(g) ==CH3OCH3(g)+H2O(g)的ΔH= (2b+2c+d) kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗铜精炼后的阳极泥含有Cu、Ag和Au(金)等。湿法处理阳极泥的一种工艺流程如下:

(1)在粗铜精炼过程中,粗铜与电源的__________极(填正、负)连接;阴极的电极反应式为______________________________________________________。
(2)在浸铜过程中,浸铜反应的离子方程式为_______________________________________________________,
生产中实际需要H2O2的量要远远超过浸铜所需的理论用量,可能的原因是________________________________________________。
(3)已知:浸金时,Au转化为AuCl4-。在理论上,提取金的过程中反应消耗NaClO3和H2C2O4的物质的量之比为__________。
(4)已知: 浸银时发生反应AgCl+2SO32-![]() Ag(SO3)23-+Cl-;Ag(SO3)23-将HCHO氧化为CO32-。
Ag(SO3)23-+Cl-;Ag(SO3)23-将HCHO氧化为CO32-。
①为减少废液排放,充分利用资源,向浸银残液中通入气体X得到Na2SO3再生液,X是__________。
②在提取银过程中,其他条件不变,Na2SO3再生液的循环使用次数与银的浸出率关系如图所示。

试结合平衡移动原理,解释产生这种变化的原因_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1mol/LCH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+对于该平衡,下列叙述正确的是( )
CH3COO-+H+对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
元素 | A | B | C | D |
性质结构信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(1)写出B原子的电子排布式__________
(2)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为__________,简要描述该配合物中化学键的成键情况:__________
(3)“。”表示氢原子,小黑点“·”表示没有形成共价键的最外层电子,短线表示共价键。

则在以上分子中,中心原子采用sp3杂化形成化学键的是__________(填序号);在②的分子中有__________个σ键和__________个π键
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如下图所示:
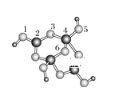
在Xm-中,硼原子轨道的杂化类型有__________;配位键存在于__________原子之间(填原子的数字标号);m=__________(填数字)
(5)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀;在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,则第一种配合物的化学式为__________,第二种配合物的化学式为_________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应:aX(g)+bY(g)![]() cZ(g)+dW(g)反应达到平衡后,将气体体积压缩到
cZ(g)+dW(g)反应达到平衡后,将气体体积压缩到
原来的一半,当再次达到平衡时,W的浓度为原平衡状态的1.8倍。下列叙述正确的是
A. 平衡向正反应方向移动 B. (a+b)>(c+d)
C. Z的体积分数变大 D. X的转化率变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。下列说法错误的是
为阿伏加德罗常数的值。下列说法错误的是
A. 0.1mol![]() 和0.1mol
和0.1mol![]() 于密闭容器中充分反应,反应后分子总数为0.2
于密闭容器中充分反应,反应后分子总数为0.2![]()
B. 向过氧化钠中通入足量的二氧化碳,当固体增重28g,转移电子数为l![]()
C. 在标准状况下,22.4LHF与![]() 个
个![]() 中含有的电子数相同
中含有的电子数相同
D. 含有![]() 个
个![]() 胶粒的氢氧化铁胶体中,铁元素的质量大于56g
胶粒的氢氧化铁胶体中,铁元素的质量大于56g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中溶质的物质的量浓度为1mol/L的是( )
A. 将58.5g NaCl溶解在1L水中
B. 将1L 10mol/L的硫酸加入9L水中
C. 将11.2L HCl气体溶于水配成0.5L溶液
D. 将40g NaOH溶解在少量水中,再加蒸馏水直到溶液体积为1L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com