
【题目】下列事实与胶体性质无关的是
A.豆浆中加入CaSO4制豆腐
B.清晨在茂密的森林里看到缕缕阳光穿过林木枝叶
C.FeCl3溶液中加入NaOH溶液产生红褐色沉淀
D.江河入海口常有三角洲形成
科目:高中化学 来源: 题型:
【题目】在一个体积固定的密闭容器中,进行可逆反应A(s)+3B(g)![]() 3C (g) 。下列叙述中表明该可逆反应一定达到平衡状态的是
3C (g) 。下列叙述中表明该可逆反应一定达到平衡状态的是
①C的生成速率与C的分解速率相等;②单位时间内生成amol A,同时生成3amol B;
③B的浓度不再变化; ④混合气体总的物质的量不再发生变化;
⑤A、B、C的物质的量之比为1:3:3; ⑥混合气体的密度不再变化;
A. ①③⑥ B. ①③④⑥ C. ①②③ D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水需处理达标后才能排放,下列废水处理的方法合理的是( )
A. 用中和法除去废水中的酸
B. 用混凝剂除去废水中的重金属离子
C. 用氯气除去废水中的悬浮物
D. 用臭氧除去废水中的异味
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性小组用含铬废水制取具有强氧化性的重铬酸钾(K2Cr2O7),实验方案如下:
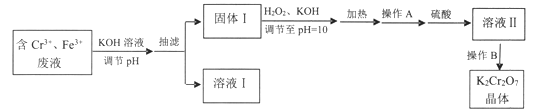
已知:
①Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+
2CrO42-(黄色)+2H+
②金属离子沉淀的PH如下:
离子 | 开始沉淀的PH | 沉淀完全的PH |
Cr3+ | 4.9 | 6.8 |
Fe3+ | 1.5 | 4.1 |
③不同温度下化合物的溶解度如下:
物质 | 溶解度/(g/110g水) | ||
0℃ | 40℃ | 80℃ | |
K2SO4 | 7.4 | 14.8 | 21.4 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
请回答:
(1)操作A的名称是____,加入硫酸的目的是_____。
(2)写出固体1中加入H2O2和KOH溶液后发生反应的离子方程式________。
(3)操作B由多步组成,获得K2Cr2O7晶体的操作依次是:蒸发浓缩、操作1、洗涤1、操作2、抽滤、洗涤2、干燥。则下列说法正确的是__________。
A.操作1和操作2分别是趁热过滤和冷却结晶
B.洗涤1和洗涤2所用的洗涤剂分别为0℃的冷水和80℃的热水
C.当溶液出现过饱和现象时,振荡容器或用玻璃棒轻轻摩擦器壁均可促使晶体析出
D.进行洗涤2操作时,可用摩尔盐[(NH4)2SO4·FeSO4·6H2O]标准溶液滴定,反应的离子方程式:
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
①请简述将已用移液管吸取的待测液转移至锥形瓶中的操作__________。
②滴定时,先称取0.5000g K2Cr2O7 产品,溶于水配成100mL溶液,用0.1000mol/L的摩尔盐标准溶液进行滴定,数据记录如下:
实验序号 | 待测样品溶液的体积/mL | 0.1000mol/L摩尔盐溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 24.98 |
2 | 25.00 | 1.56 | 29.30 |
3 | 25.00 | 1.00 | 26.02 |
则测得K2Cr2O7产品的纯度是_________(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水FeCl3在空气中易潮解,遇水水解,加热易升华,实验室可用下列装置制备。
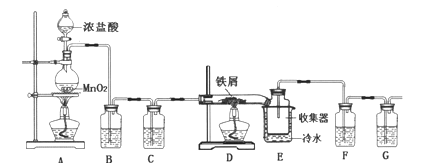
(1)反应开始后,装置D硬质玻璃管中出现的现象为__________。
(2)装置F中所盛的试剂为___________。
(3)下列有关该实验的说法中,不正确的是__________。
A.B装置的作用是除去HCl,并能减少Cl2的溶解
B.E装置中冷水的作用是冷却,使FeCl3冷却沉积
C.若氯气不足则会产生FeCl2
D.向烧瓶中加入足量的AgNO3和稀硝酸,可确定生成的MnCl2的质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
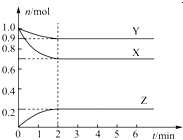
(1)该反应的化学方程式为____________。
(2)反应开始至2min,用气体Z表示的反应速率为____________。
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的____________倍;
②若此时将容器的体积缩小为原来的0.5倍,达到平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应的正反应为________反应(填“放热”或“吸热”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验测得,4g甲醇液态在氧气中充分燃烧生成二氧化碳气体和液态水时释放出90kJ的热量,试写出甲醇燃烧的热化学方程式:_________________。
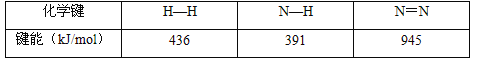
(2) 已知反应N2(g)+3H2(g)![]() 2NH3(g) △H=a kJ/mol。试根据表中所列键能数据估算a的数值:_________________。
2NH3(g) △H=a kJ/mol。试根据表中所列键能数据估算a的数值:_________________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。已知:
C(s,石墨)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1 ①
2H2(g)+O2(g)== 2H2O(I) △H2=-571.6kJ·mol-1 ②
2C2H2(g)+5O2(g)== 4CO2(g)+2H2O(I) △H3 =-2599kJ·mol-1③
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CCTV“科技博览”栏目报道,我国科学家首创以CO2为原料制备可降解塑料——聚二氧化碳。下列相关说法合理的是( )
A. 聚二氧化碳塑料属于高分子化合物
B. 聚二氧化碳塑料是无机化合物
C. 聚二氧化碳塑料中含有CO2分子
D. 使用聚二氧化碳塑料易造成环境污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液,经测定ClO-与ClO3-的浓度之比为1∶3,则反应时被还原的氯元素与被氧化的氯元素的质量之比为 ( )
A.4∶1 B.3∶1 C.11∶3 D. 21∶5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com